Rosa L. – Rose
Die Taxonomie der Gattung Rosa ist auf Grund ihrer Reproduktionsbiologie, ihrem Mangel an eindeutigen morphologischen und teilweise auch genetischen Unterschieden zwischen vielen Arten und durch den Einfluss der Rosenzucht mit erheblichen Schwierigkeiten behaftet (z.B. Wissemann 2003, Koopman et al. 2008, Smulders et al. 2011, Kellner et al. 2014).
Die Fortpflanzungsstrategien von Rosen reichen von Apomixis über Selbst- bis zur Fremdbestäubung (Wissemann & Hellwig 1997, Werlemark 2000, Nybom et al. 2006, Wissemann & Ritz 2007). Hybridisierung spielt eine bedeutsame Rolle bei der Artbildung der Gattung (Wissemann & Ritz 2005, 2007, Joly et al. 2006, De Cock et al. 2008, Ritz et al. 2011, Smulders et al. 2011, Fougère-Danezan et al. 2015).
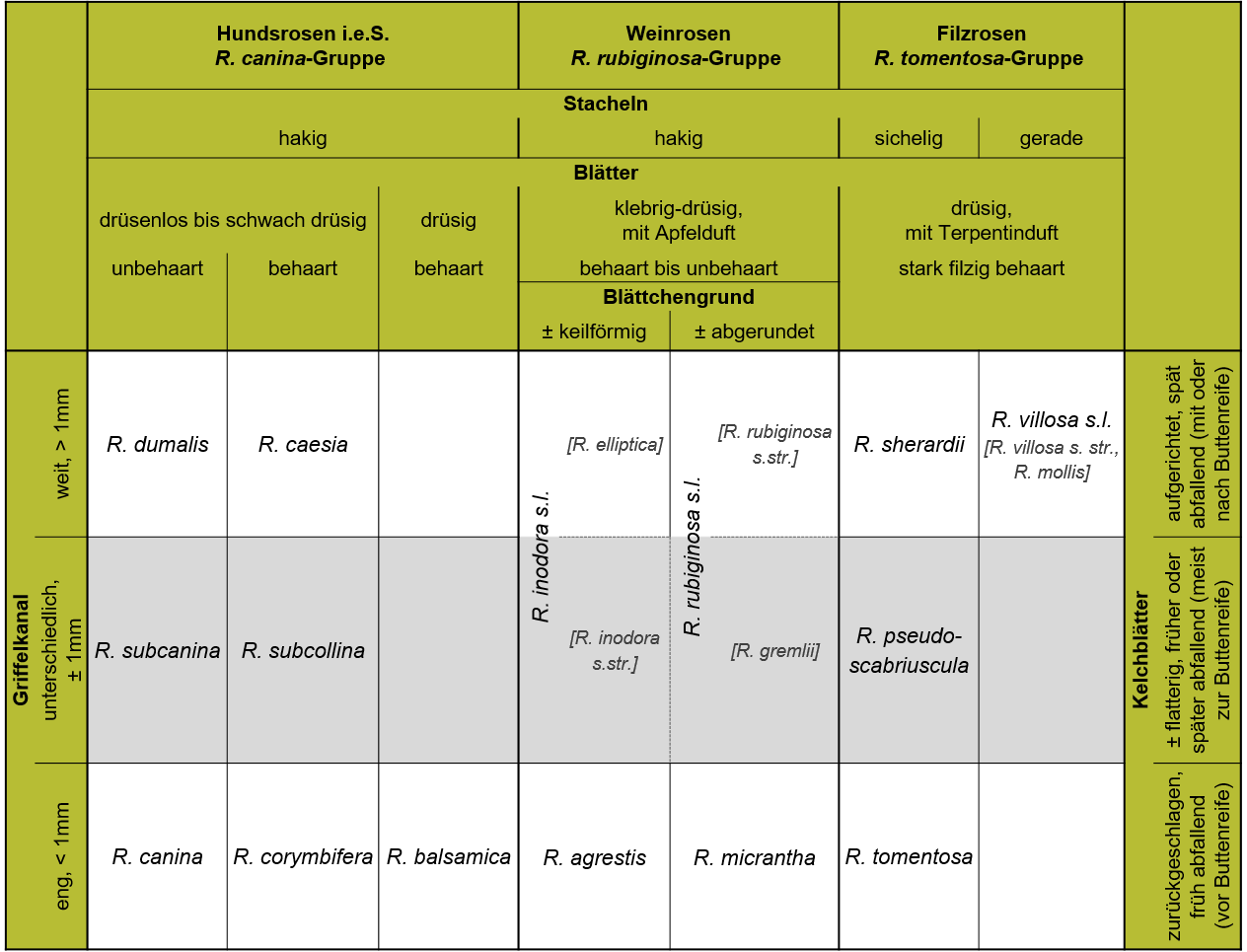
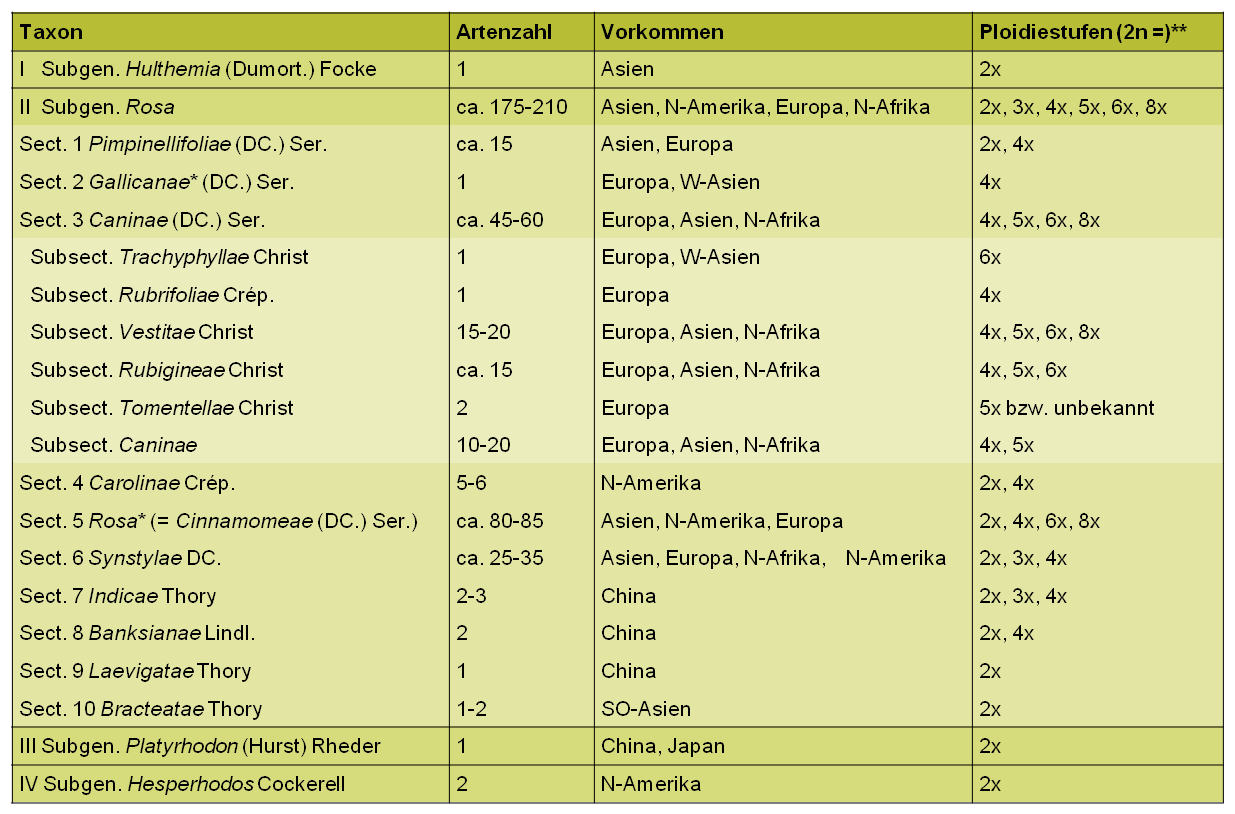
Von der in Mitteleuropa artenreichsten und taxonomisch kritischsten Gruppe, den Hundsrosen (sect. Caninae (DC.) Ser.), sind im Gegensatz zu fast allen anderen Sektionen ausschließlich polyploide Vertreter bekannt (vgl. Tab. 2). Molekulare Analysen bestätigen den schon lange Zeit vermuteten hybridogenen Ursprung der Sektion, an deren Entstehung vermutlich Vorfahren aus den Sektionen Syntstylae und Rosa beteiligt waren (Ritz et al. 2005, Kovarik et al. 2008, Zhang et al. 2013, Fougère-Danezan et al. 2015). Gekennzeichnet sind die Caninae durch ihre einzigartige irreguläre Meiose, die auch als Canina-Meiose bezeichnet wird (Täckholm 1920, 1922). Diese ermöglicht den überwiegend pentaploiden (2n = 5x = 35) Hundsrosen die geschlechtliche Fortpflanzung trotz ihres ungeraden Chromosomensatzes.
Während der Canina-Meiose paaren sich nur 14 Chromosomen (2 Sätze á 7 homologer Chromosomen = Bivalente), während die übrigen 21 Chromosomen ungepaart verbleiben (Univalente). Rekombination findet somit nur zwischen den Bivalenten statt. An die Pollenkörner wird nur ein Satz der Bivalente, an die Eizellen werden neben einem Satz der Bivalente auch alle 21 Univalente übertragen. Bei ebenfalls in der Sektion auftretenden tetra- bzw. hexaploiden Sippen ändert sich nur die Zahl der Univalente (14 bzw. 28) in den Eizellen. Dadurch vereint die Canina-Meiose sexuelle Fortpflanzung (rekombinierende Bivalente) und Apomixis (nicht rekombinierende, maternal vererbte Univalente), weshalb die Hundsrosen auch als hemisexuell bezeichnet werden (Nybom et al. 2004, 2006).
Durch die ungleichen Anteile väterlichen und mütterlichen Erbguts ähneln die Nachkommen bei Hundsrosen stark dem mütterlichen Elter (matrokline Vererbung). Für einige bestimmungsrelevante Fruchtmerkmale (Kelchblatthaltung und -haftungsdauer, Durchmesser des Griffelkanals) konnte allerdings eine paternale Vererbung nachgewiesen werden (Ritz & Wissemann 2003). Vom Geschlecht der Eltern unabhängig scheint die Ausprägung der Wuchsform zu sein (Wissemann et al. 2006). Auf Grund dieser genetischen Besonderheiten sind Primärhybriden im Feld fast unmöglich als solche zu erkennen. Sie sind meist fertil und entsprechen oft bereits beschriebenen Arten (Wissemann & Hellwig 1997, Ritz & Wissemann 2003). Für die in der Regel hexaploide Rosa micrantha Sm. wurde bereits nachgewiesen, dass sie eine interspezifische Hybride aus R. rubiginosa L. (Saatelter) und R. canina L. oder R. corymbifera Borkh. darstellt (Ritz & Wissemann 2011, Herklotz et al. 2017). Analog dazu vermuten Herklotz & Ritz (2014) und Herklotz et al. 2017, dass auch Rosa agrestis Savi eine interspezifische Hybride aus R. inodora Fr. und R. canina L. oder R. corymbifera Borkh. ist.
Die stark ausgeprägte Kreuzungsfähigkeit und eine wahrscheinlich rezente, nacheiszeitliche Radiation liefern Erklärungsansätze für die geringe morphologische Merkmalsdifferenzierung zwischen vielen Rosensippen (Wissemann & Ritz 2005, De Cock et al. 2008). Die mitteleuropäischen Wildrosen, speziell die Hundsrosen, sind polymorphe Sippen. Ihre morphologischen Merkmale variieren innerartlich zwischen geographisch getrennten Populationen (Henker 2000, De Cock et al. 2008) und teilweise auch jahrweise am gleichen Individuum (Herklotz & Ritz 2014). Die Abgrenzung der Sippen gegeneinander ist demzufolge schwierig und stark vom angewendeten Artkonzept (bzw. taxonomischen Rangstufenkonzept) abhängig (Henker 2000).
Sehr enge Artauffassungen unter Berücksichtigung kleinster morphologischer Unterschiede führten bis zum Ende des 19. Jh. zu einer inflationären Beschreibung neuer Arten, besonders innerhalb der Hundsrosen (vgl. Wissemann 2003). Erst Christ (1873) leitete eine Wende ein, indem er bei der Artbeschreibung die Gesamtheit der Merkmale berücksichtigte und dabei verbindenden Merkmalsgruppen ein stärkeres Gewicht beimaß als trennenden Einzelmerkmalen.
Christ (1873, modifiziert von Dingler 1907) hat als erster zwei verschiedene Wuchstypen innerhalb der Hundsrosen erkannt. Diese Wuchstypen beschreiben eine mit dem Habitus korrelierte Kombination von morphologischen Merkmalen und werden einem Vorschlag von Reichert (1998a) folgend als L- (von lat. laxus = locker) und D-Typ (von lat. densus = dicht) bezeichnet. Intermediäre Übergangsformen werden als L/D-Typen zusammengefasst (für Merkmale der Typen vgl. Beschreibung). Dem L- bzw. D-Typ können die morphologisch relativ gut fassbaren „Eckarten“ innerhalb der Caninae zugeordnet werden. Dazwischen gibt es jeweils eine große Gruppe von Zwischenformen mit schwankender Merkmalsausprägung, die dem L/D-Typ zugeordnet und ebenfalls als eigene Arten angesehen wurden bzw. werden (Tab. 1). Wie Kreuzungsexperimente zeigten, können diese nicht als Primärhybriden zwischen den „Eckarten“ bewertet werden, da Kreuzungen zwischen L- und D-Typ-Rosen keine L/D Typen sondern ebenfalls L- oder D-Typen ergeben (Wissemann & Hellwig 1997, Ritz & Wissemann 2003). Dies deutet darauf hin, dass die jeweilige 3-Arten-Gruppe (2 enger definierte Eckarten + 1 lose definierte Zwischenart) eigentlich nur eine 2-Arten-Gruppe repräsentiert, deren Vertreter in ihren Merkmalen im Bereich des L/D-Typs überlappen (Wissemann et al. 2006). In ihrer Neubearbeitung für die Rothmaler-Exkursionsflora unterscheidet Ritz (2021) basierend auf morphologischen und genetischen Studien (Herklotz et al. 2017) bei den Weinrosen nur noch zwei Arten innerhalb der ehemaligen 3-Arten-Gruppen. Für die Filzrosen der R. tomentosa-Gruppe und die Hundsrosen i.e.S. liegen bislang noch keine vergleichbaren morphologischen und genetischen Studien vor, weshalb Ritz (2021) bei diesen noch alle drei Wuchstypen als eigenständige Arten führt.
Neben den natürlichen Ursachen wird die Rosentaxonomie zusätzlich auch durch die lange Kulturgeschichte der Gattung erschwert. Schon Herrmann (1762) klagt über die Verschmelzung der Arten in der Gartenkultur, die ihre weitere Erkennbarkeit unmöglich machen würde. Seit langem kultivierte Arten wie z.B. die Apfelrose (Rosa villosa L.) sind in dieser Hinsicht besonders problematisch (vgl. Kellner et al. 2014). Weitere Beispiele für kultivierungsgeschichtlich bedingte taxonomische Probleme sind mehrere von Rosa gallica L. abstammende, hybridogene Kulturrosen, die oft als Arten angesehen werden (z.B. Rosa alba L., R. centifolia L., R. damascena Mill.; vgl. Henker 2000, Wissemann 2003). Lange Zeit war mit Rosa centifolia L. selbst der Typus der Gattung Rosa ein Vertreter dieser Gruppe (Lectotypisierung durch Britton & Brown 1913). Inzwischen wurde basierend auf einem Vorschlag von Rowley (1976, 1992) dieser ungeeignete Gattungstypus durch Rosa cinnamomea L. ersetzt (McNeill et al. 2006, App. III E3, S. 389).
Die heute allgemein gebräuchliche systematische Gliederung der Gattung Rosa basiert auf dem Klassifikationssystem von Rehder (1940) und darauf aufbauenden Aktualisierungen von Henker (2000) und Wissemann (2003). Entsprechend dieser morphologischen Klassifizierung wird die Gattung in vier Untergattungen gegliedert, von denen drei nur wenige, ausschließlich diploide Arten umfassen und auf Teilgebiete des Gattungsareals beschränkt sind. Die bei weitem größte Untergattung Rosa umfasst sowohl diploide als auch polyploide Arten und wird in 10 Sektionen unterteilt, wobei die Sektion Caninae wiederum in mehrere Untersektionen gegliedert wird (Tab. 2).
Molekularbiologisch basierte phylogenetische Untersuchungen resultierten zwar in sich zumindest partiell widersprechenden Ergebnissen, zeigen aber mehrheitlich, dass die morphologisch basierte systematische Klassifizierung der Gattung nur zum Teil aufrecht erhalten werden kann (u.a. Wissemann & Ritz 2005, Bruneau et al. 2007, De Cock et al. 2008, Koopman et al. 2008, De Riek et al. 2013, Fougère-Danezan et al. 2015, Debray et al. 2021).
** Basischromosomenzahl x = 7
Die Gattung Rosa ist nordhemisphärisch und hier im Wesentlichen in den temperierten Zonen der Holarktis verbreitet (Henker 2000). Nur vier der ca. 200 Arten besitzen auch Vorkommen in tropischen Gebirgen südlich der Holarktis. Verbreitungsschwerpunkt der Rosen ist die nemorale Zone.
In Europa ist die Gattung vom Mittelmeergebiet bis in die boreale Zone, vom Atlantik bis ins kontinentale Osteuropa und vom Tiefland bis in die subalpine Höhenstufe verbreitet (Henker 2000). Unsere heimischen Wildrosen kommen mehrheitlich an offenen Standorten, auf schwach sauren bis schwach basischen, meist kalkhaltigen Böden vor. Sehr stickstoffreiche Standorte werden in der Regel gemieden.
Die im Portal berücksichtigten Arten der Gattung Rosa sind laubwerfende, mit gleichartigen (homoeacanth) oder verschiedenartigen (heteracanth) Stacheln bewehrte Sträucher. Die spiralig angeordneten Blätter sind unpaarig gefiedert und tragen Nebenblätter. Die zwittrigen Blüten stehen in end- und achselständigen, traubigen bis rispigen, zum Teil doldig verkürzten oder auf einzelne Blüten reduzierten Blütenständen. Sie besitzen eine fünfzählige, doppelte Blütenhülle. Die Kelchblätter sind alle ungeteilt oder die beiden äußeren sind beiderseits, das mittlere nur einseitig fiederspaltig, fiederteilig oder fiederschnittig bzw. tragen einzelne fadenförmige Anhängsel. Nach der Blütezeit sind sie zurückgeschlagen, abstehend oder aufgerichtet, zur Fruchtreife abgefallen, abfallend oder an der reifen Frucht persistierend. Die Kronblätter sind rosa bis rot oder weiß gefärbt. Staub- und Fruchtblätter sind zahlreich vorhanden. Erstere sitzen am Rand des Blütenbechers (Hypanthium, krugartig eingesenktes Achsenorgan), letzere an seinem Grund oder seiner Innenwand. Der obere Teil des Blütenbechers ist als Diskus (nicht funktionstüchtig, ohne Nektarproduktion) ausgebildet, der in der Mitte vom Griffelkanal durchbrochen wird. Durch diesen treten die meist freien, nur bei wenigen Arten miteinander verwachsenen, Griffel als Bündel nach außen. Das dadurch aus dem Blütenbecher herausragende Narbenköpfchen ist halbkugelig (hutförmig) bis straußförmig (bukettförmig) gestaltet. Es liegt dem Diskus auf oder überragt ihn deutlich. Zur Fruchtzeit vergrößert sich der Blütenbecher und bildet mit den im Inneren sitzenden Nüsschen eine fleischige bis ledrige, reif rote bis orange, seltener braue oder schwarze Sammelfrucht, die Hagebutte (Butte).
Die Merkmale der für die Charakterisierung der Hundsrosen (Sektion Caninae) sehr wertvollen Wuchstypen können entsprechend Reichert (1998a) und Henker (2000) wie folgt zusammengefasst werden (vgl. auch Tab. 1):
- L-Typ (lat. laxus = locker): meist hohe Gebüsche von lockerem Wuchs, mit langen oft überhängenden, locker beblätterten Trieben; Kelchblätter nach der Blütezeit zurückgeschlagen und vor der Fruchtreife abfallend; (Blüten-) Fruchtstiele mehr als halb so lang, meist so lang, teilweise länger als Hagebutten, die Hochblätter deutlich überragend und Blütenstände dadurch aufgelockert; Griffelkanal lang und eng (ca. 0.4−0.8 mm im Durchmesser) und der Diskusring breit; Griffel fast nie wollig behaart, häufig kahl; Narbenköpfchen bukettförmig aus der Griffelkanalöffnung herausragend; lange Reifungsdauer der Hagebutten (frühe Blüte − späte Reife)
- D-Typ (lat. densus = dicht): Gebüsche von dichtem, gedrungenem Wuchs, kurzästig, dicht beblättert; Kelchblätter nach der Blütezeit schräg bis steil aufgerichtet und an der reifen Frucht vorhanden; (Blüten-) Fruchtstiele meist bis halb so lang, teilweise so lang wie Hagebutten, durch die Hochblätter mehr oder weniger verdeckt und Blütenstände dadurch gedrungen; Griffelkanal kurz und weit (Durchmesser ab ca. 1,1 mm) und Diskusring schmal; Griffel dicht wollig behaart; Narbenköpfchen hutförmig dem Diskus aufliegend; kurze Reifungsdauer der Hagebutten (späte Blüte − frühe Reife)
- L/D-Typ (Übergangsform zwischen L- und D-Typ): Wuchsform und weitere Merkmale mehr oder weniger intermediär; Kelchblätter nach der Blütezeit flatterig (aufgerichtet bis zurückgeschlagen), früher oder später abfallend; Griffelkanal mäßig eng bis weit (Durchmesser ± 1 mm)
(vgl. Henker 2000, 2011)
Wie bei allen bestimmungskritischen Gruppen ist auch bei den meisten Rosenarten für die Bestimmung nicht nur ein Merkmal, sondern der ganze Merkmalskomplex einer Art zu berücksichtigen. Da die Hagebutte einige diagnostisch besonders wichtige, artdifferenzierende Merkmale (Griffelkanaldurchmesser; Gestalt des Diskus; Bau, Haltung und Haftungsdauer der Kelchblätter; Länge des Fruchtstiels; Bedrüsung an Fruchtstiel und Frucht) ausweist, sind viele Rosenarten erst zur Zeit der Buttenrötung oder -reife sicher bestimmbar. Zu beachten ist hierbei, dass die mittlere Butte eines Fruchtstandes (Zentralbutte) größer und kürzer gestielt ist sowie einen größeren Griffelkanaldurchmesser und eine abweichende Gestalt aufweist. Angaben zu Fruchtmerkmalen beziehen sich deshalb immer auf Einzelbutten oder seitliche Hagebutten eines Fruchtstandes. Reichert (1998b, 2011) empfiehlt sogar ausschließlich Einzelbutten (auf die Zentralbutte reduzierte Fruchtstände, die aus einblütig angelegten Blütenständen hervorgegangen sind) zu Vergleichsmessungen heranzuziehen. Entsprechend seiner Untersuchungen nehmen diese in ihrer Merkmalsausprägung eine Mittelstellung zwischen Zentral- und Seitenbutten gut entwickelter Fruchtstände ein. Dies verdeutlicht, dass es auch bei Nichtberücksichtigung der stark abweichenden Zentralbutten in jedem Fall wichtig ist, mehr als eine Frucht für die Bestimmung heranzuziehen. Henker (2000) empfiehlt z.B. für den Griffelkanaldurchmesser besonders bei kritischen Rosenbelegen den Mittelwert aus etwa 10 Messungen zu bestimmen. Des Weiteren ist im Hinblick auf die diagnostisch wichtigen Merkmale folgendes zu berücksichtigen:
- Wuchsform − im Gelände dokumentieren
- Bestachelung − bezieht sich im Allgemeinen auf Bestachelung der Blütentriebe; an den sterilen Jahrestrieben oft abweichend, aber verschiedenartige Bestachelung hier oft besonders gut ausgeprägt
- Blattbehaarung − Verkahlung im Laufe der Vegetationsperiode möglich, im Zweifel jüngste Blätter prüfen
- Rhachis − gilt auch als kahl wenn einzelne Haare in Rille an Rhachisoberseite oder an Ansatzstellen der Blättchen vorhanden sind
- Bedrüsung − Rückgang im Jahresverlauf möglich; Drüsenköpfe können abrechen; Duft der Drüsensekrete durch Zerreiben frischer Blätter prüfen (an Herbarbelegen gewöhnlich nicht mehr wahrnehmbar)
- Kelchblätter − anhaltende Trockenheit kann zu frühzeitigerem Abfall der Kelchblätter führen (besonders bei Wind) und auch das Aufrichten der Kelchblätter nach der Blüte stören (d.h. flattriges Verhalten der Kelchblätter bei Arten mit normalerweise an der Frucht aufgerichteten Kelchblättern möglich), (vgl. auch Anmerkungen/Beobachtungen zur Witterungsabhängigkeit der Kelchblatthaltung und -haftungsdauer bei Christ 1873 S. 20, Bomble 2012, Herklotz & Ritz 2014)
- Griffelkanal − Durchmesser an der engsten Stelle bestimmen; bei ovalen Griffelkanälen (selten) Mittelwert aus kleinstem und größtem Durchmesser verwenden
- Narbenköpfchen − nach Trocknen der Hagebutte (Herbarbeleg) kann durch Schrumpfung ein Buketttyp vorgetäuscht werden
- Länge des Fruchtstiels im Verhältnis zur Frucht − bei einer Schätzung des Längenverhältnisses wird die Fruchtstiellänge auf Grund einer optischen Täuschung meist überschätzt (Reichert 2011), der Autor vertritt zudem die Ansicht, dass diesbezügliche Angaben in der Bestimmungsliteratur (auch bei Henker 2000) oft auf Schätzungen beruhen und Messungen des Merkmals zu abweichenden Angaben führen würden
Zur Anfertigung nachbestimmbarer Herbarbelege sollten Rosen idealerweise kurz vor oder während der Hagebuttenrötung (August bis Anfang September) gesammelt werden. Dies hat den Vorteil, dass an den reifenden Früchten die Kelchblätter ihre endgültige Haltung eingenommen haben aber noch relativ fest sitzen (an reifen Früchten einiger Arten sind die Kelchblätter bereits abgefallen). Da beim Herbarisieren die Kelchblätter dennoch abfallen können, empfiehlt es sich aber in jedem Fall die Kelchblatthaltung zu dokumentieren. Für Belege sollten am besten neben einem Zweig mit mehreren Butten und charakteristischer Bestachelung zusätzlich auch drei unter dem Kelchblattansatz abgeschnittene Oberteile der Frucht oder alternativ drei zentral längsgeschnittene Butten (jeweils zwei ohne und eine mit Griffelbündel) herbarisiert werden. Als vorteilhaft empfiehlt Henker (2000) zudem die Herbarisierung von Jahrestrieben (besonders bei ungleichartiger oder abweichender Bestachelung), zwei typischen Laubblättern mit flach ausgebreiteten Nebenblättern, blütentragenden Zweige desselben Strauches und einzelner Kronblättern (mit Dokumentation ihrer Farbe). Die Einbeziehung der Blüten ist wünschenswert, in der Regel erfordert dies aber eine Kennzeichnung der Pflanze und eine zweite Aufsammlung.
Für das Portal wurde die Artkonzepte von Henker (2000, 2011) und Ritz (2021) verwendet. Dementsprechend wird im Artteil auf eine Unterscheidung infraspezifischer Taxa verzichtet. Bei einigen der verwendeten Belege finden sich dennoch Bestimmungen von Unterarten bzw. Varietäten. In diesen Fällen werden auf der Belegseite unter "Bemerkungen zur Bestimmung" die wichtigsten Merkmale des Taxons angegeben.
Das Portal enthält alle in Deutschland vorkommenden Arten, die in Henker (2000, 2011) verschlüsselt sind und ergänzend dazu auch Rosa gremlii (Christ) Gremli. Entsprechend der Neubearbeitung für die Rothmaler-Exkursionsflora (Ritz 2021) wurden einige der bislang als eigenständige Arten behandelten Sippen allerdings unter einem weiter gefassten Taxon (sensu lato) zusammengefasst.
Die angegebenen Merkmale der Arten folgen im Wesentlichen den Bearbeitungen von Henker (vgl. Sammel- und Bestimmungshinweise). Für die Merkmale von R. gremlii (Christ) Gremli und R. multiflora Thunb. wurden zusätzlich die Arbeiten von Henker & Schulze (1999) bzw. Gu & Robertson (2003) herangezogen.
Für die Bereitstellung instruktiver Belege danken wir Heinz Hencker und Hans Reichert sowie dem Herbarium der Justus-Liebig Universität Gießen (GI) und dem Herbarium der Martin-Luther Universität Halle (HAL) sowie der Botanischen Staatssammlung München (M).
Bomble, F. W. 2012. Zur Taxonomie von Rosa brilonensis und ähnlichen Arten im Aachener Raum. Floristische Rundbriefe 45/46: 21-31.
Britton, N. L. & Brown, A. 1913. An illustrated flora of the northern United States, Canada and the British Possessions. Vol. II: Amaranthaceae to Loganiaceae. 2. Auflage. Charles Scribner's sons, New York: 282.
Bruneau, A., Starr, J. R. & Joly, S. 2007. Phylogenetic relationships in the genus Rosa: New evidence from chloroplast DNA sequences and an appraisal of current knowledge. Systematic Botany 32: 366-378.
Christ, H. 1873. Die Rosen der Schweiz mit Berücksichtigung der umliegenden Gebiete Mittel- und Süd-Europas: Ein monographischer Versuch. H. Georg’s Verlag, Basel, Genf, Lyon. (Volltext)
Debray K., Le Paslier M.C., Berard A., Thouroude T., Michel G., Marie-Magdelaine J., Bruneau A., Foucher F. & Malecot V. 2021. Unveiling the patterns of reticulated evolutionary processes with phylogenomics: hybridization and polyploidy in the genus Rosa. Systematic Biology 71(3): 547-569. (https://doi.org/10.1093/sysbio/syab064)
De Cock, K., Vander Mijnsbrugge, K., Breyne, P., Van Bockstaele, E. & Van Slycken, J. 2008. Morphological and AFLP-based differentiation within the taxonomical complex section Caninae(subgenus Rosa). Annals of Botany 102: 685-697.
De Riek, J., De Cock, K., Smulders, M. J. M. & Nybom, H. 2013. AFLP-based population structure analysis as a means to validate the complex taxonomy of dogroses (Rosa section Caninae). Molecular Phylogenetics and Evolution 67: 547-559.
Dingler, H. 1907. Versuch einer Erklärung gewisser Erscheinungen in der Ausbildung und Verbreitung der wilden Rosen. Mitteilungen des Naturwissenschaftlichen Vereins zu Aschaffenburg 6: 1-38.
Fougère-Danezan, M., Joly, S., Bruneau, A., Gao, X.-F. &Zhang, L.-B. 2015. Phylogeny and biogeography of wild roses with specific attention to polyploids. Annals of Botany 115: 275-291.
Gebauer, P. & Müller, S. 2007. Beitrag zur Kenntnis der Wildrosenflora Ostsachsens. Teil 1: Die Weinrosen (Rosa L. sect. Caninae DC. subsect. Rubigineae Chr.). Berichte der Naturfoschenden Gesellschaft der Oberlausitz 15: 33-64. (Volltext)
Graham, G. G. & Primavesi, A. L. 1993. Roses of Great Britain and Ireland. BSBI Handbook 7. Botanical Society of the British Isles, London.
Gu, C. & Robertson, K. R. 2003. Rosa multiflora Thunb. In: Wu, Z.-Y., Raven, P. H. & Hong, D.-Y. (Hrsg.). Flora of China. Vol. 9. Missouri Botanical Garden Press, St. Louis: 370.
Henker, H. & Schulze, G. 1999. Rosacolumnifera - eine neue Rosenart aus der Weinrosen-Gruppe. Acta Rhodologica 2: 13-18.
Henker, H. 2000. Rosa L. In: Conert, J., Jäger, E. J., Kadereit, J. W., Schulze-Motel, W., Wagenitz, G. & Weber, H. E. (Hrsg.). Gustav Hegi -Illustrierte Flora von Mitteleuropa. Bd. IV, Teil 2C Spermatophyta: Angiospermae: Dicotyledones 2 (4) Rosaceae (Rosengewächse). 2. Auflage. Parey Buchverlag Berlin: 1-108.
Henker, H. 2011. Rosa L. In: Jäger, E. J. (Hrsg.). Rothmaler, Exkursionsflora von Deutschland. Gefäßpflanzen: Grundband. 20. Auflage. Spektrum AkademischerVerlag Heidelberg: 444-553.
Herklotz, V. & Ritz, C. M. 2014. Spontane Hybridisierung von Hundsrosen (Rosa L . sect . Caninae (DC). Ser.) an einem natürlichen Vorkommen in der Oberlausitz (Sachsen, Deutschland). Peckiana 9: 119-131. (Volltext Zeitschriftenband)
Herklotz V.& Ritz C.M. 2017. Multiple and asymmetric origin of polyploid dogrose hybrids (Rosa L. sect. Caninae (DC.) Ser.) involving unreduced gametes. Annals of Botany 120: 209-220. (https://doi.org/10.1093/aob/mcw217)
Herklotz, V., Mieder, N. & Ritz, C. M. 2017. Cytological, genetic and morphological variation in mixed stands of dogroses (Rosa section Caninae; Rosaceae) in Germany with a focus on the hybridogenic R. micrantha. Botanical Journal of the Linnean Society 184: 254-271. (https://doi.org/10.1093/botlinnean/box025)
Herklotz V., Kovařík A., Lunerová L., Lippitsch S., Groth M. & Ritz C.M. 2018. The fate of ribosomal RNA genes in spontaneous polyploid dogrose hybrids (Rosa L. sect. Caninae (DC.) Ser.) exhibiting non-symmetrical meiosis. Plant Journal, 94 (1): 77-90. (https://doi.org/10.1111/tpj.13843)
Herrmann, J. 1762. Dissertatio Inauguralis Botanico-Medica de Rosa. Straßburg. Officina J.H. Heitz. (Volltext)
Joly, S., Starr, J. R., Lewis, W. H. & Bruneau, A. 2006. Polyploid and hybrid evolution in roses east of the Rocky Mountains. American Journal of Botany 93: 412-425. (Volltext)
Kaplan, K. 2015. Rosa mollis, eine eigene Sippe neben Rosa villosa? – Ein altes Problem der Rosensystematik, nachvollzogen in Aosta/Italien. Floristische Rundbriefe 48/49: 13-42.
Keller, R. 1931. Synopsis Rosarum Spontanearum Europae Mediae. Übersicht über die mitteleuropäischen Wildrosen mit besonderer Berücksichtigung ihrer schweizerischen Fundorte. Denkschriften der Schweizerischen Naturforschenden Gesellschaft Bd. LXV. Kommissionsverlag von Gebrüder Fretz A.G., Zürich. (Textband) (Atlasband)
Kellner, A., Ritz, C. M. & Wissemann, V. 2012. Hybridization with invasive Rosa rugosa threatens the genetic integrity of native Rosa mollis. Botanical Journal of the Linnean Society 170: 472-484. (Volltext)
Kellner, A., Ritz, C. M. & Wissemann, V. 2014. Low genetic and morphological differentiation in the European species complex of Rosa sherardii, R. mollis and R. villosa (Rosa section Caninae subsection Vestitae). Botanical Journal of the Linnean Society 174: 240-256. (https://doi.org/10.1111/boj.12124)
Koopman, W. J. M., Wissemann, V., De Cock, K., Van Huylenbroeck, J., De Riek, J., Sabatino, G. J. H., Visser, D., Vosman, B., Ritz, C. M., Maes, B., Werlemark, G., Nybom, H., Debener, T., Linde, M. & Smulders, M. J. M. 2008. AFLP markers as a tool to reconstruct complex relationships: A case study in Rosa (Rosaceae). American Journal of Botany 95: 353-366.
Kovarik, A., Werlemark, G., Leitch, A. R., Souckova-Skalicka, K., Lim, Y. K., Khaitová, L., Koukalova, B. & Nybom, H. 2008. The asymmetric meiosis in pentaploid dogroses (Rosa sect. Caninae) is associated with a skewed distribution of rRNA gene families in the gametes. Heredity 101: 359-367.
Lange, H. 1961. Die Säulengrifflige Rose (Rosa stylosa Desv.) in Westfalen. Natur und Heimat 21: 41-44.
Lauber, K. & Wagner, G. 1996. Flora Helvetica. Verlag Paul Haupt Bern, Stuttgart, Wien.
Lüth, M. 2000. Rosa abietina und andere Funde von Wildrosen aus Südbaden. Acta Rhodologica II: 65-74.
McNeill, J., Barrie, F. R., Burdet, H. M., Demoulin, V., Hawksworth, D. L., Marhold, K., Nicolson, D. H., Prado, J., Silva, P. C., Skog, J. E., Wiersema, J. H. &Turland, N. J. (Hrsg.) 2006. International Code of Botanical Nomenclature (Vienna Code) adopted by the Seventeenth International Botanical Congress Vienna, Austria, July 2005. Regnum Vegetabile 146. Gantner Verlag, Ruggell, Liechtenstein. (Online-Version)
Nieschalk, A. & Nieschalk, C. 1975. Beiträge zur Kenntnis der Rosenflora Nordhessens I. Der Formenkreis um Rosa elliptica Tausch (Keilblättrige Rose). Philippia II/5: 299-316. (Volltext)
Nieschalk, A. & Nieschalk, C. 1978. Beiträge zur Kenntnis der Rosenflora Nordhessens II. Der Formenkreis um Rosa agrestis Savi (Feldrose). Philippia III/5: 389-407. (Volltext)
Nieschalk, A. & Nieschalk, C. 1980. Beiträge zur Kenntnis der Rosenflora Nordhessens III. Der Formenkreis um Rosa micrantha Borrer ex. Sm. (Kleinblütige Rose). Philippia IV/3: 213-233. (Volltext)
Nieschalk, A. & Nieschalk, C. 1981. Beiträge zur Kenntnis der Rosenflora Nordhessens IV. Der Formenkreis um Rosa rubiginosa L. (Weinrose). Phillipia IV/5: 388-413. (Volltext)
Nieschalk, C. 1986. Beiträge zur Kenntnis der Rosenflora Nordhessens V. Die Formenkreise um Rosa tomentosa Sm., Filzige Rose, Rosa scabriuscula Sm. in Sowerby, Kratz-Rose, Rosa villosa L., Zotttige Rose, Apfel-Rose und Rosa sherardii Davies, Übersehene Rose. Philippia V/4: 318-345. (Volltext)
Nieschalk, C. 1989. Beiträge zur Kenntniss der Rosenflora Nordhessens VI. Gattung Rosa L. sect. Caninae DC. subsect. Eucaninae Crépin. Die Formenkreise der Rosa canina-Gruppe. Philippia VI/2: 155-199. (Volltext)
Nieschalk, C. 1993. Beiträge zur Kenntnis der Rosenflora Nordhessens VII. Die Formenkreise um Rosa arvensis Hudson (Kriechende Rose), Rosa pimpinellifolia L. (Bibernell-Rose) und Rosa jundzillii Besser (Rauhblättrige Rose) sowie einiger in Nordhessen nur angepflanzt oder verwildert vorkommender Rosenarten. Philippia VI/4: 313-330. (Volltext)
Nybom, H., Esselink, G. D., Werlemark, G. & Vosman, B.2004. Microsatellite DNA marker inheritance indicates preferential pairing between two highly homologous genomes in polyploid and hemisexual dog-roses, Rosa L. Sect. Caninae DC. Heredity 92: 139-150.
Nybom, H., Esselink, G. D., Werlemark, G., Leus, L. & Vosman, B. 2006. Unique genomic configuration revealed by microsatellite DNA in polyploid dogroses, Rosa sect. Caninae. Journal of Evolutionary Biology 19: 635-648.
Raabe, U., Büscher, D., Fasel, P., Foerster, E., Götte, R., Haeupler, H., Jagel, A., Kaplan, K., Keil, P., Kulbrock, P., Loos, G.H., Neikes, N., Schumacher, W., Sumser, H. & Vanberg, C. unter Mitarbeit von Buch, C., Fuchs, R., Gausmann, P., Gorissen, I., Gottschlich, G., Haecker, S., Itjeshorst, W., Korneck, D., Matzke-Hajek, G., Schmelzer, M., Weber, H.E. & Wolff-Straub, R. 2011. Rote Liste und Artenverzeichnis der Farn- und Blütenpflanzen –Spermatophyta et Pteridophyta – in Nordrhein-Westfalen. In: Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen (Hrsg.). Rote Liste der gefährdeten Pflanzen, Pilze und Tiere in Nordrhein-Westfalen. 4. Fassung. LANUV-Fachbericht 36, Bd. 1: 49-183.
Rehder A. 1940. Manual of cultivated trees and shrubs hardy in North America. Macmillan, New York.
Reichert, H. 1996. Die Legimität der von Linné publizierten Namen mitteleuropäischer Wildrosen - Ein Überblick über den gegenwärtigen Stand der Diskussion. Gleditschia 24: 13-23.
Reichert, H. 1998a. Die zwei Wuchstypen bei Rosen der Sektion Caninae und ein Vorschlag für eine Kurzbezeichnung derselben. Acta Rhodologica 1: 29-35.
Reichert, H. 1998b. Die Infloreszenz mitteleuropäischer Wildrosen der Sektion Caninae in Hinblick auf ihre Bestimmungsmerkmale. Acta Rhodologica 1: 83-86.
Reichert, H. 2011. Quantitative Merkmale mitteleuropäischer Wildrosen (Rosaceae: Rosa) und ihre Eignung als Bestimmungsmerkmale. Kochia 5: 39-65.
Ritz, C. M. 2021. Rosa. L. In: Müller, F., Ritz, C., Welk, E. & Wesche, K. (Hrsg.). Rothmaler, Exkursionsflora von Deutschland. Gefäßpflanzen: Grundband. 22. Auflage. Springer Spektrum: 404-411.
Ritz, C. M. & Wissemann, V. 2003. Male correlated non-matroclinal character inheritance in reciprocal hybrids of Rosa section Caninae (DC.) Ser. (Rosaceae). Plant Systematics and Evolution 241: 213-221.
Ritz, C. M. & Wissemann, V. 2011. Microsatellite analyses of artificial and spontaneous dogrose hybrids reveal the hybridogenic origin of Rosa micrantha by the contribution of unreduced gametes. Journal of Heredity 102: 217-227.
Ritz, C. M., Köhnen, I., Groth, M., Theissen, G. & Wissemann, V. 2011. To be or not to be the odd one out - Allele-specific transcription in pentaploid dogroses (Rosa L. sect. Caninae (DC.) Ser). BMC Plant Biology 11: 37.
Ritz, C. M., Schmuths, H. & Wissemann, V. 2005. Evolution by reticulation: European dogroses originated by multiple hybridization across the genus Rosa. Journal of Heredity 96: 4-14.
Rowley, G. D. 1976. Typification of the Genus Rosa L. Taxon 25: 181.
Rowley, G. D. 1992. Typ. cons. Prop.: R. cinnamomea L. In: Nicolson, D. H. (Hrsg.). Seventy-two proposals for the conservation of types of selected Linnaean generic names, the report of Subcommittee 3C on the lectotypification of Linnaean generic names. Taxon 41: 568-569.
Seitz, B., Ristow, M., Klemm, G., Rätzel, S., Schulze, G. & Hoffmann, M. 2004. Zur Verbreitung der Wildrosen und verwilderten Kulturrosen in Berlin und Brandenburg. Verhandlungen des Botanischen Vereins von Berlin und Brandenburg 137: 137-267.
Sell, P. & Murrell, G. 2014. Rosa L. In: Flora of Great Britain and Ireland. Vol. 2: Capparaceae–Rosaceae. Cambridge University Press: 352-385.
Smulders, M. J. M., Arens, P., Koning-Boucoiran, C. F. S., Gitonga, V. W. , Krens, F. A., Atanassov, A., Atanassov, I., Rusanov, K .E., Bendahmane, M., Dubois, A., Raymond, O., Caissard, J. C. , Baudino, S., Crespel, L., Gudin, S., Ricci, S. C., Kovatcheva, N., Van Huylenbroeck, J., Leus, L., Wissemann, V., Zimmermann, H., Hensen, I., Werlemark, G. & Nybom, H. 2011. Rosa. In: Kole, C. (Hrsg.). Wild crop relatives: genomic and breeding resources: plantation and ornamental crops. Springer-Verlag, Berlin, Heidelberg: 243-275.
Täckholm, G. 1920. On the cytology of the genus Rosa. Svensk Botanisk Tidskrift 14: 300-311. (Volltext)
Täckholm, G. 1922. Zytologische Studien über die Gattung Rosa. Acta Horti Bergiani 7: 97-381. (Volltext)
Timmermann, G. 1992. Rosa L. 1753. In: Sebald, O., Seybold, S. & Philippi, G. (Hrsg.). Die Farn- und Blütenpflanzen Baden-Württembergs. Bd. 3: Spezieller Teil (Spermatophyta, Unterklasse Rosidae) Droseraceae bis Fabaceae. Eugen Ulmer Verlag Stuttgart: 64-101.
Timmermann, G. & Müller, T. 1994. Wildrosen und Weißdorne Mitteleuropas. Landschaftsgerechte Sträucher und Bäume. Verlag des Schwäbischen Albvereins e.V. Stuttgart.
Urban, R. & Mayer, A. 2008. Floristische und vegetationskundliche Besonderheiten aus den Bayerischen Alpen - Funde im Rahmen der Alpenbiotopkartierung - Teil 3. Berichte der Bayrischen Botanischen Gesellschaft 78: 103-128. (Volltext Zeitschriftenband)
Werlemark, G. 2000. Evidence of apomixis in hemisexual dogroses, Rosa section Caninae. Sexual Plant Reproduction 12: 353-359.
Wissemann, V. & Hellwig, F. H. 1997. Reproduction and hybridisation in the Genus Rosa, Section Caninae (Ser.) Rehd. Botanica Acta 110: 251-256.
Wissemann, V. & Ritz, C. M. 2005. The genus Rosa (Rosoideae, Rosaceae) revisited: molecular analysis of nrITS-1 and atpB-rbcL intergenic spacer (IGS) versus conventional taxonomy. Botanical Journal of the Linnean Society 147: 275-290.
Wissemann, V. & Ritz, C. M. 2007. Evolutionary patterns and processes in the genus Rosa (Rosaceae) and their implications for host-parasite co-evolution. Plant Systematics and Evolution 266: 79-89.
Wissemann, V. 2003. Conventional taxonomy of wild roses. In: Roberts, A., Debener, T & Gudin, S. (Hrsg.). Encyclopedia of Rose Science. Elsevier, London: 111-117.
Wissemann, V., Gallenmüller, F., Ritz, C., Steinbrecher, T. & Speck, T. 2006. Inheritance of growth form and mechanical characters in reciprocal polyploid hybrids of Rosa section Caninae - Implications for the ecological niche differentiation and radiation process of hybrid offspring. Trees 20: 340-347.
Zhang, J., Esselink, G. D., Che, D., Fougère-Danezan, M., Arens, P. & Smulders, M. J. M. 2013. The diploid origins of allopolyploid rose species studied using single nucleotide polymorphism haplotypes flanking a microsatellite repeat. Journal of Horticultural Science and Biotechnology 88: 85-92.
Wesenberg, J., Gebauer, P. & Ritz, C.M. 2015 (aktualisiert 2024). Rosa L. In: Dressler, S., Gregor, T., Hellwig, F. H., Korsch, H., Wesche, K., Wesenberg, J. & Ritz, C. M. Bestimmungskritische Taxa zur Flora von Deutschland. Herbarium Senckenbergianum Frankfurt/Main, Görlitz & Herbarium Haussknecht Jena. [online] https://bestikri.senckenberg.de




