Ranunculus L. sect. Batrachium DC. – Wasserhahnenfuß
Nach den Untersuchungen von Hörandl et al. (2005) umfasst die Sektion Batrachium eine Gruppe von ca. 30 Arten, die in einer Klade von gelbblühenden terrestrischen und semiaquatischen Ranunculus-Arten eingebunden sind. Deswegen wird Batrachium hier nicht als Untergattung, sondern als Sektion innerhalb der Gattung Ranunculus betrachtet. Alle Arten der Sektion Batrachium sind durch eine starke phänotypische Variabilität in Abhängigkeit von Umweltfaktoren und vom Witterungsverlauf gekennzeichnet. Die Arten sind in der Regel fertil. Sterilität sowie unvollständige Ausbildung von Blütenstielen, Kronblättern und Früchten deuten auf Hybridisierung hin, können aber durch ungünstige Umweltbedingungen hervorgerufen werden. Hybridbildung und Introgression treten verbreitet auf, wobei Hybriden der häufigsten Art R. peltatus mit anderen häufigen Arten (R. fluitans bzw. R. trichophyllus) die Mehrzahl der hybridverdächtigen Fälle ausmachen. Primärhybriden sind wegen der großen morphologischen Variabilität der Elternarten oft schwer von diesen zu unterscheiden. Sterile Klone können neben fertilen Formen überdauern. Apomikten sind bei Batrachium bisher nicht nachgewiesen, obwohl Cook (1966) diese Möglichkeit diskutiert. Neben phänotypischer Variabilität und Hybridisierung könnte auch die zeitweilige Persistenz von Epimutationen, hervorgerufen durch wechselnden Selektionsdruck aufgrund wechselnder anthropogener Einflüsse auf die Gewässer, eine Rolle spielen.
Das hier vertretene Artkonzept ist taxonomisch konservativ und zielt auf morphologisch abgrenzbare Einheiten ab. Diese sind für praktische Zwecke (Naturschutz, Gewässerschutz) unabdingbar. Diese „Morphospezies“ können genetisch heterogen sein und spezielle regionale Morphotypen ausbilden. Ebenso sind geringfügige Abweichungen im DNA-Gehalt oder aber Fehlen einzelner Chromosomen (Aneuploidie) von geringer Bedeutung, solange der Phänotyp nicht stark abweicht. Die hier verwendete Artabgrenzung basiert insbesondere auf den Arbeiten von Cook (1966, 1986) und Pizarro (1995). Cook (1966, 1986) eliminierte bis auf wenige Ausnahmen (bei R. penicillatus, R. trichophyllus und R. peltatus) alle subspezifischen Sippen, insbesondere die Varietäten und Formen, die im Laufe des 19. und frühen 20. Jahrhunderts beschrieben worden waren. Dieses Konzept hat sich in Europa weitgehend etabliert, außer in Skandinavien (vgl. Hong 1991, Dahlgren & Jonsell 2001). Aktuelle Bearbeitungen in den Nachbarländern (Schweiz: Desfayes 2016; Österreich: Englmaier 2016; Tschechische Republik: Koutečky et al. 2021) entsprechen dieser Vorgehensweise.
Wiegleb et al. 2017 wandten das Cook’sche Konzept nunmehr weltweit an, wobei alle subspezifischen Sippen entweder zu Arten erhoben oder gestrichen wurden, je nachdem, ob sie morphologisch abgrenzbar sind oder nicht. Einige außereuropäische Arten, die von Cook (1966) mit europäischen Arten vereint worden waren, wurden wieder abgetrennt, da sie deutlich genug verschieden sind. Diese Vereinheitlichung war nötig, da sich vor allem in China (Wang & Tamura 2001) und Nord-Amerika (Whittemore 1997) abweichende Konzepte entwickelt hatten. Dabei war der Rückgriff auf russische Arbeiten (Tsvelev 1998; Luferov 2002) sehr hilfreich. Die neuere Bearbeitung von Prančl et al. (2018; Tschechische Republik) verfolgt jedoch wieder eine andere Abgrenzung der Arten. Dort werden innerhalb der traditionellen Arten „kryptische“ Arten bzw. Linien („lineages“) unterschieden.
Während die Beschreibung von Hybriden in Großbritannien und Frankreich eine lange Tradition hat (vgl. Lansdown 2007, 2015), wurden diese in Deutschland erst seit ca. 1970 vereinzelt erkannt (Vollrath & Kohler 1972, Wiegleb & Herr 1983). Insgesamt sind vor allem die Hybriden aufgeführt, deren Nachweis ohne genetische oder zytologische Untersuchungen möglich ist. Das Auftreten seltener Hybriden wie R. trichophyllus × R. rionii, R. baudotii × R. aquatilis = R. ×lamberti A. Félix, R. baudotii × R. peltatus und R. baudotii × R. trichophyllus = R. ×segretii A. Félix ist wahrscheinlich, aber nicht bestätigt. Die taxonomische und nomenklatorische Behandlung der Hybriden ist in den aktuellen Bestimmungsschlüsseln (Wiegleb et al. 2017, Wiegleb 2020, 2021) noch nicht konsistent, da es für einige Hybriden keinen binären Namen gibt bzw. in anderen Fällen die Beschreibung unzureichend oder die Hybrididentität fraglich ist.
Die hybridogene Art R. penicillatus enthält in der hier verwendeten Abgrenzung auch die Primärybriden von R. fluitans × R. peltatus, da eine morphologische Unterscheidung nicht möglich ist. Der Hybrid- bzw. Introgressionsschwarm R. peltatus × R. penicillatus gehört formal auch in diesen Formenkreis. Diese Form ist häufig und auch gut ansprechbar. (Nomenklatorische Anmerkung: Der korrekte Name für diese Art ist wahrscheinlich R. pseudofluitans (Syme) Newbould, da Webster (1988) Typusbelege falsch zugeordnet hat).
Die hybridogene Art R. pseudofluitans enthält in der gegenwärtigen Abgrenzung auch die Primärhybriden von R. fluitans × R. circinatus, da eine morphologische Unterscheidung ebenfalls nicht möglich ist. (Nomenklatorische Anmerkung: Wahrscheinlich hat diese Art bisher keinen gültigen Namen, obwohl sie von Vollrath & Kohler (1972) exakt beschrieben wurde).
Die Hybriden von R. fluitans × R. trichophyllus, die einen ähnlichen Formenschwarm bilden, werden nicht in gleicher Form als Artkomplex behandelt. Es besteht eine zu starke morphologische Überschneidung mit den beiden vorgenannten Sippen, die eine exakte Abgrenzung nicht erlaubt. (Nomenklatorische Anmerkung: Der korrekte Name für diese Art wäre vermutlich R. calcareus Butcher, der aber auch für R. pseudofluitans verwendet wurde. Der zum Teil verwendete Name R. ×bachii Wirtgen bezieht sich vermutlich auf R. fluitans × R. baudotii und wird zudem auch für den Hybriden R. fluitans × R. aquatilis verwendet (vgl. Wiegleb 2020). Aus diesem Grund werden hier die Hybriden von R. fluitans mit R. trichophyllus, R. baudotii und R. aquatilis als „R. fluitans-Hybriden“ zusammengefasst, bis eine Klärung erfolgt ist.)
Auch R. baudotii und R. aquatilis sind hybridogene Komplexarten, an deren Zustandekommen vor allem R. fluitans, R. trichophyllus und R. peltatus beteiligt sind. Die morphologische Trennung von häufigen Hybriden wie R. peltatus × R. trichophyllus bzw. R. peltatus × R. aquatilis ist nicht immer eindeutig.
Insgesamt wurden weltweit 30 Arten innerhalb der Sektion Batrachium unterschieden (Wiegleb et al. 2017). Diese Zahl ist sicher zu gering, da weitere gute Arten (R. fucoides, R. lutarius, R. pachycaulon) zum Zeitpunkt der Publikation noch unzureichend bekannt waren. Sowohl die südamerikanischen als auch neuseeländischen Formen stellen bisher unbeschriebene Arten dar. Weitere Taxa können in Äthiopien, Tibet und Nordostasien vermutet werden.
Die am weitesten verbreitete Art ist R. trichophyllus, die fast weltweit (subkosmopolitisch) verbreitet ist, jedoch in bisher unzureichend getrennte Morpho- und Karyotypen zerfällt. Andere Arten wie R. ashibetsuensis, R. bungei, R. confervoides, R. flavidus, R. kadzusensis, R. lobbii, R. nipponicus, R. porteri, R. schmalhausenii, R. tripartitus und R. vertumnus kommen nur in einem begrenzten Gebiet vor. Westeuropa ist der Schwerpunkt der Artdiversität mit 18 Arten. Hohe Artenzahlen finden sich in Osteuropa (11), Nordafrika (10) sowie West- (9) und Zentralasien (8). Ähnlich hohe Werte gelten für Nordchina, die pazifische Küste Russlands und die nordamerikanische Westküste. Hohe Artenzahlen sind typisch für ozeanische und subozeanische Klimaregionen. In Deutschland sind 12 Arten sicher nachgewiesen. Für Europa und das Mittelmeergebiet kommt man auf 22 Arten.
Die Auswertung der bisherigen phylogenetischen Untersuchungen legt nahe, dass die Sektion aus drei Kladen besteht (Zalewska-Gałocz et al. 2015, Wiegleb et al. 2017, Koutečky et al. 2021):
Klade 1 besteht aus kleinen amphibischen Arten, die neben den Schwimmblättern oft keine Tauchblätter ausbilden. Hierzu gehören im Gebiet R. hederaceus und R. ololeucos.
Klade 2 umfasst sowohl schwimmblättrige wie untergetauchte Arten und stellt den Großteil der Arten im Gebiet: R. peltatus, R. fluitansv, R. baudotii, R. saniculifolius, R. penicillatus, R. pseudofluitans, R. trichophyllus und R. aquatilis.
Klade 3 besteht aus Arten ohne Schwimmblätter mit kurzen meist sparrig abstehenden Blättern. Hierzu gehören im Gebiet R. circinatus und R. rionii.
Die Basiszahl der Chromosomen ist in allen Kladen 2n = 16 (R. hederaceus, R. fluitans, R. saniculifolius, R. circinatus, R. rionii). Diese Arten der Kladen 1 und 3 sind in geringem Maße an Hybridisierungsprozessen beteiligt. Durch Auto- und Allopolypoidisierung sind vor allem in Klade 2 polyploide Komplexarten entstanden. Diese haben Chromosomenzahlen von 2n = 32 oder 48 (R. peltatus, R. baudotii, R. penicillatus, R. pseudofluitans, R. trichophyllus, R. aquatilis). Kreuzungsbarrieren zwischen diesen Arten sind nur gering ausgeprägt. Chromosomenzahlen von 2n = 24 oder 40 sind in der Regel ein Anzeichen für Hybridisierung, weswegen auch die Versuche, innerhalb von Klade 2 Untergruppen zu trennen, bisher kein konsistentes Bild liefern. Für R. fluitans sind neben 2n = 16 triploide Formen (2n = 24) sicher nachgewiesen (vgl. Wiegleb et al. 2017).
In den Hilfstabellen (Wiegleb 2018) werden statt der Kladen morphologische Artengruppen verwendet, die im Gelände unmittelbar ansprechbar sind. Gruppe 1: Kleine amphibische Arten (meist nur mit flächigen Blättern); Gruppe 2: Große Arten der Fließgewässer, oft ohne Schwimmblätter; Gruppe 3: Überwiegend mittelgroße Arten mit regelmäßig ausgebildeten Schwimmblättern; Gruppe 4: Überwiegend kleine bis mittelgroße Arten ohne Schwimmblätter.
Wie bei allen Wasserpflanzen wird das Vorkommen der Sippen der Sektion Batrachium von einer Vielzahl von Faktoren beeinflusst. Wichtigste Faktoren sind das Licht sowie der anorganische Kohlenstoff. Stickstoff und Phosphor (Trophie) spielen eine geringere Rolle, vor allem in Fließgewässern. Hinzu kommen der Salzgehalt (Chlorid- bzw. Sulfatgehalt), die mechanische Belastung durch Strömung oder Wellenschlag sowie die Temperatur. Auffällig ist die Trennung von Hart- und Weichwasserarten, die mit der Verfügbarkeit von Hydrogenkarbonat korreliert (Tab. 1). Dem entsprechen ökophysiologische Eigenschaften der Arten, die Hydrogenkarbonat assimilieren können (z. B. R. trichophyllus) oder aber nicht. Möglicherweise verfügen diese Arten über spezielle Anpassungen, um bei geringen Hydrogenkarbonat-Konzentrationen auch ohne Schwimmblätter auskommen zu können.
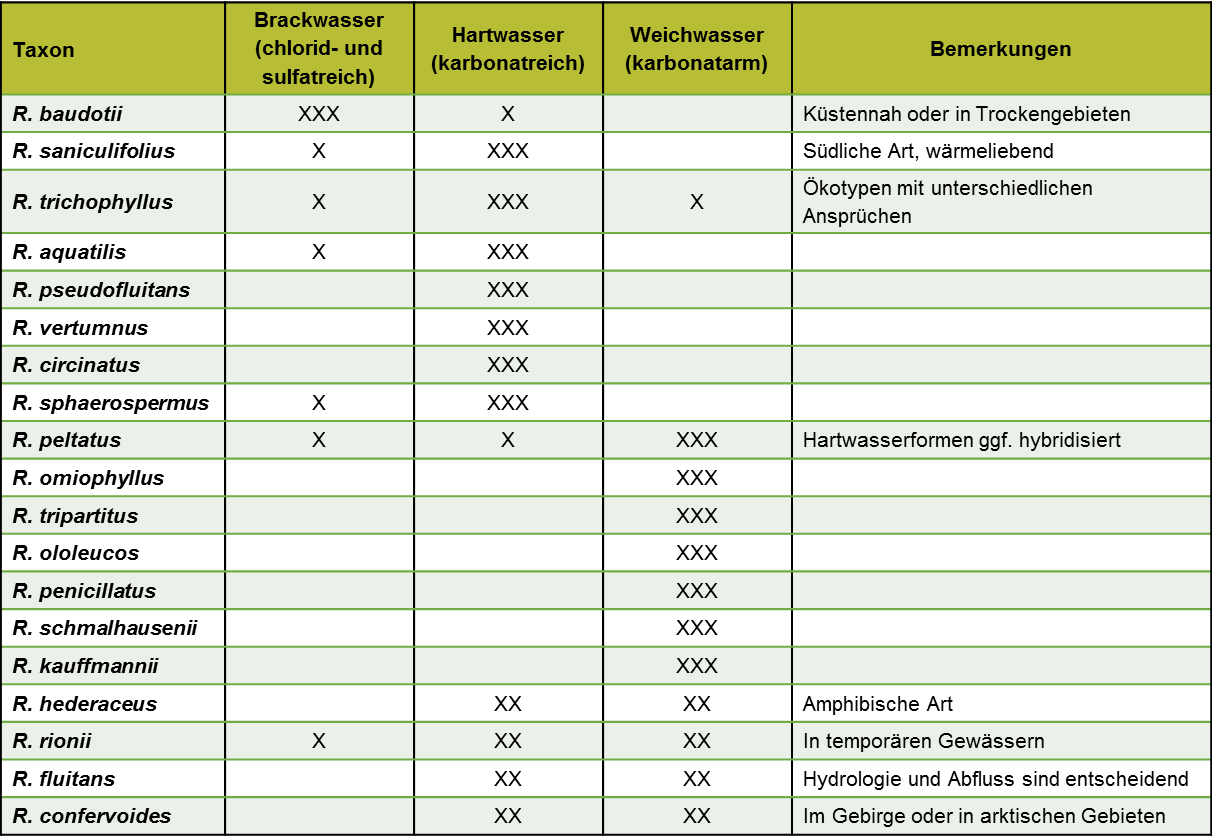
Anthropogene Einflüsse spielen eine große Rolle für die Verbreitung der Batrachium-Arten. Die Eutrophierung der Stillgewässer und das damit verbundene Algenwachstum haben einen negativen Einfluss. In den Fließgewässern spielt Eutrophierung nur eine geringe Rolle. Im Flachland führen Abkopplung der Flüsse vom Grundwassereinstrom, Eintiefung der Flutrinne sowie morphologische Vereinheitlichung zu verändertem Abflussverhalten und Temperaturregime. Je nach Gegebenheiten ist eine Potamalisierung oder Rhitralisierung (vgl. Weyer 2017) zu beobachten. Austrag von gelösten Stoffen aus dem Einzugsgebiet, vor allem Eisenocker, führt zu Trübung. Ob die damit zusammenhängenden Veränderungen des Standortes einen Effekt auf das Vorkommen von Batrachium-Arten haben, hängt wesentlich von deren Wuchsform ab. Die Beschattung von Gewässern hat meist keinen Einfluss auf die Artenzusammensetzung, eher auf die Biomasse. Im Mittelgebirge können Kanalisierung oder Talsperrenbau sogar einen positiven Einfluss auf Fließwasser-Arten haben wegen der Regulierung des Abflusses und der Vermeidung von Hochwasserspitzen. Auch Teichwirtschaft und Gewässerunterhaltung können zur Verbreitung von Arten beitragen. Die besten Wuchsbedingungen für Batrachium-Arten finden sich nicht unbedingt in naturnahen Gewässern.
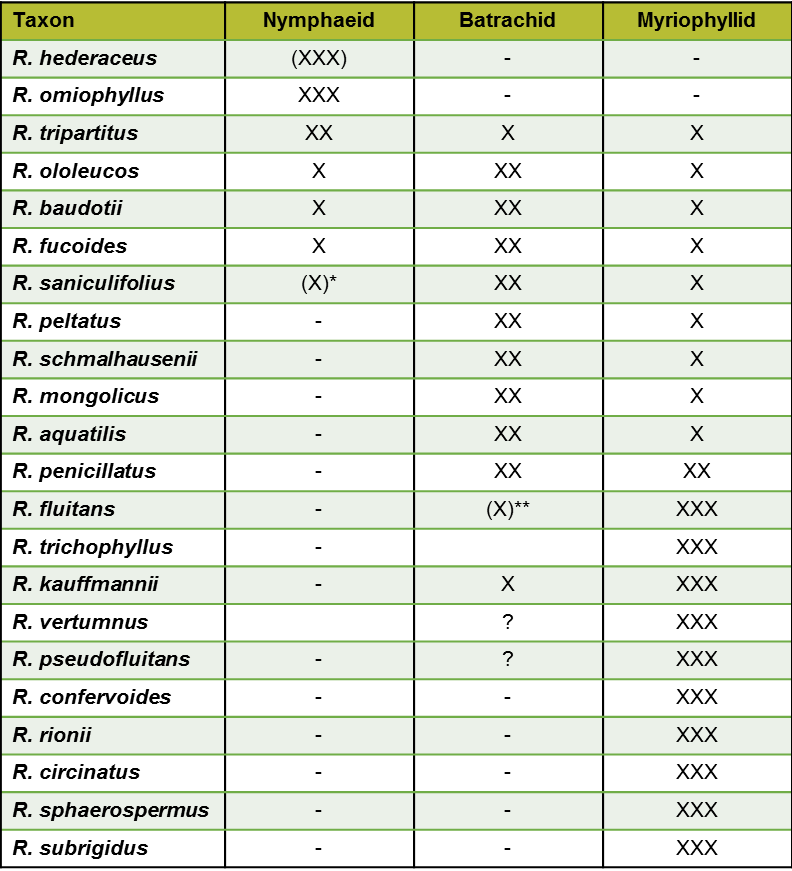
Die Sektion Batrachium umfasst aquatische oder amphibische krautige Pflanzen mit weißen oder gelb-weißen Blüten. Ein wichtiges Merkmal aller Wasserpflanzen ist die Wuchsform (vgl. Weyer & Schmitt 2011), aus der sich ökologische Schlussfolgerungen ableiten lassen, da sie den Gastaustausch und die Nährstoffaufnahme unmittelbar beeinflusst. Bei Batrachium treten drei Wuchsformen auf, die nymphaeide (nur mit Schwimmblättern), die batrachide (mit Schwimm- und Unterwasserblättern) und die myriophyllide Wuchsform (nur mit Unterwasserblättern) (Weyer & Schmidt 2011). Einige Arten treten nur in einer Wuchsform auf, andere können in allen drei Wuchsformen beobachtet werden (Tab. 2). Die Wuchsformen in Kombination mit Lebensform und Größe sind geeignet zur Vorsortierung der Arten in morphologische Artengruppen. Die aktuellen Bestimmungsschlüsseln (Wiegleb et al. 2017, Wiegleb 2020, 2021) und Hilfstabellen (Wiegleb 2018), folgen weitgehend diesem Prinzip.
* wahrscheinlich nur im ostmediterranen Verbreitungsgebiet, nicht in Deutschland
** Einige Formen weisen Tauchblätter auf, die sehr Schwimmblattartig gestaltet sind. Es handelt sich aber nicht um echte Schwimmblätter
Einige der aquatischen Batrachium-Arten können zusätzlich Landformen bilden, die entweder flächige und fein zerteilte Blätter (R. aquatilis, R. peltatus) oder nur fein zerteilte, oft starre Blätter haben (R. circinatus, R. trichophyllus). Diese Landformen können in den meisten Fällen nicht bestimmt werden, selbst wenn Blüten und Früchte vorhanden sind. Die Blütenmerkmale können von denen der aquatischen Formen stark abweichen. Nur wenn in unmittelbarer Nähe aquatische Formen wachsen, ist eine sichere Zuordnung möglich.
Die Probenahme von Wasserpflanzen sollte nach den von K. van de Weyer (z.B. Weyer 2017) entwickelten Methoden stattfinden, ungeachtet dessen, ob eine floristische, vegetationskundliche oder ökologische Fragestellung vorliegt. Bei flachen Gewässern (bis 0,8 m) kann die Probenahme vom Ufer aus oder bei Durchwatung von Hand erfolgen. Es ist zu prüfen, ob Bestände homogen sind und nicht ggf. mehrere Formen enthalten. Gewässer bis 4 m Tiefe sind grundsätzlich mit einer verlängerbaren Harke zu beproben. Schmale Fließgewässer sind von beiden Seiten zu begehen und zu beproben, kleine Stillgewässer sind zu umrunden. Größere Flachgewässer sollten mit dem Boot befahren werden. Tiefere Gewässer (Seen, große Fließgewässer) müssen grundsätzlich betaucht werden. Aufsammlung von verdrifteten Pflanzen am Ufer kann nur als Notbehelf angesehen werden, da diese eine atypische Morphologie aufweisen können. Zudem ist die Herkunft oft unsicher.
Von allen gesammelten Pflanzen sind grundsätzlich Herbarbelege der Größe ca. A3 anzufertigen. Angaben ohne Beleg sind grundsätzlich fragwürdig. Die Exemplare müssen so präpariert werden, dass die diagnostischen Merkmale sichtbar sind. Größere Belege sind nach innen zu falten und ggf. zu teilen und auf mehrere Blätter zu verteilen. Fundort, Standort, Datum und Sammler sind unbedingt zu vermerken. Merkmale, die beim Trocknen nicht oder nur schwer konserviert werden können, wie Struktur der Tauchblätter, Farbe des Stängels, Farbe und Form der Kronblätter, sind zu notieren und fotografisch zu dokumentieren.
Zur Bestimmung der Arten, insbesondere der Fließgewässerformen, sind nur die mittleren und oberen Abschnitte fertiler Sprosse geeignet, die sowohl typisch ausgebildete Tauch- und Schwimmblätter als auch Blüten und reife Früchte tragen. Ganzjährige auftretende sterile Sprosse haben in der Regel längere Tauchblätter. Oft sind Mehrfachaufsammlungen im Jahreslauf oder langjährige Beobachtungen des gleichen Bestandes nötig, um zu einer sicheren Bestimmung zu kommen. Bei Beobachtungen, die mehrere Jahre auseinanderliegen, ist nicht gewährleistet, dass die gleichen Sippen gefunden werden, da insbesondere in kleinen Stillgewässern und in schnell fließenden Abschnitten von Fließgewässern eine Kolonisierungs-Aussterbe-Dynamik zu beobachten ist. Die Kultivierung in Becken oder Tanks ist nur bei den kleinen amphibischen Arten hilfreich. Die Fließgewässerformen wachsen in Kultur nicht gut und bilden nur untypische Kümmerformen aus.
Die Bestimmung der Arten ist in der Regel allein mit einem dichotomen Schlüssel nicht möglich, obwohl es sich nur um 12 Arten sowie 10-12 Hybriden handelt. Selten sind jedoch alle wichtigen Merkmale an einer Pflanze vorhanden, zudem sind die Überschneidungen sehr groß. Einzelmerkmale dürfen nicht absolut gesehen werden. Wenn bei Merkmalskombinationen einige Merkmale stimmen, andere nicht, müssen die Merkmale regelbasiert gewichtet werden. Neben den Hauptbestimmungsschlüsseln (Wiegleb et al. 2017, Wiegleb 2020, 2021) wurden deswegen Tabellen erstellt (Wiegleb 2018), die Alleinstellungsmerkmale der Arten beinhalten (Merkmale, die nur in einer oder zwei Arten auftreten) sowie Merkmale, die für die Art charakteristisch sind, auch wenn sie in anderen ggf. nicht näher verwandten Arten auch auftreten können. Zudem wurden die Merkmale hinsichtlich der Tatsache bewertet, ob eine Abweichung das morphologische Artkonzept überschreitet oder nicht. Wichtig ist es, immer den Entwicklungszustand der Pflanze zu beachten. Sind die Pflanzen aus Samen gekeimt, oder aus übersandeten Vorjahrssprossen gewachsen, oder aus abgerissenen Fragmenten? Wie war der Witterungsverlauf? Gab es Trockenphasen oder starken Anstieg des Wasserstands? Gab es mechanische Störungen?
Für die Erkennung der Hybriden ist darauf zu achten, welche potentiellen Elternarten in der Umgebung oder im Gewässersystem vorkommen. Wie ist deren Häufigkeit, wie sind die Blühzeiten? Gibt es Ökotone, wo Arten unterschiedlicher Standortansprüche gemeinsam vorkommen können, die sonst nur getrennt auftreten? Batrachium-Hybriden sind nicht intermediär (wegen Dominanz, Rückkreuzung bzw. F2-Aufspaltung). Sie zeigen oft verringerte Vitalität und Fertilität, auf keinen Fall Heterosis-Effekte, wie von Prančl et al. (2018) postuliert. Hybriden sind in der Regel wenigsten teilweise fertil, denn sonst gäbe es keine Hybrid- oder Introgessionsschwärme. Man findet einzelne entwickelte Früchte oft erst am fünften oder sechsten Blütenstiel. Zu achten ist auch auf Schwierigkeiten bei der Entwicklung, etwa atypische Verzweigungen, achselständige Kurztriebe mit andersartigen Tauchblättern, ggf. mit dem Blütenstiel verwachsen, unterentwickelte Blütenstiele oder ungeöffnete Blüten mit abortiven Kelch- und Kronblättern.
Für eine umfassende Beschreibung der Arten ist eine Vielzahl von Merkmalen zu berücksichtigen, auf die in den Schlüsseln und Tabellen (Wiegleb et al. 2017, Wiegleb 2018, Wiegleb 2020, 2021) zurückgegriffen wird. Die Merkmale sind nicht alle gleich wichtig. Für ein vertieftes Verständnis ist es jedoch nötig, sich damit auseinanderzusetzen und ggf. auch Korrelationen zwischen den Merkmalen zu berücksichtigen. Die Unterscheidung der Merkmalsausprägungen folgt Pizarro (1995) und Wiegleb et al. (2017), sofern nicht anders vermerkt. Wichtige Merkmale sind:
Ganze Pflanze
Lebensform − Lebensdauer: einjährig, zweijährig, mehrjährig. Saisonalität: wintergrün, sommergrün. Anpassung an den aquatischen Lebensraum: Amphiphyt, Hydrophyt.
Wuchsform der Wasserform − Nymphaeide, Batrachide, Myriophyllide. Wasserform: aufrecht, aufrecht-ausgebreitet, niederliegend. Landform: niederliegend-rasig, in Büscheln wachsend.
Blätter und Stängel
Schwimmblätter (flächige Blätter) − Anwesend oder fehlend. Blattstellung: wechselständig, gegenständig. Größe (Spreite ohne Blattstiel): Länge, Breite, im mm. Form: nierenförmig, herzförmig, kreisförmig, halbkreisförmig. Anzahl der Primärlappen: 3, 5, 7. Tiefe der Einschnitte: eingeschnitten bis zu 1/3, 1/2, 2/3 oder mehr als 2/3 der Spreite. Form der Primärlappen (im Fall tiefer Einschnitte): mit schmaler Basis, parallelrandig, keilförmig zugespitzt (mit breiter Basis). Gesamtzahl der Sekundärlappen. Rand: ganzrandig, gewellt, gezackt (spitz oder stumpf), gezähnt. Winkel der basalen Bucht der Spreite, in °. Behaarung: behaart, unbehaart. Blattstiel: Länge, absolut in cm, in Verhältnis zur Spreite.
Übergangsblätter − Anwesend oder fehlend. Form: ‘aquatilis-Typ’: breit-flächig mit basalen Kapillarsegmenten (Cook, 1966: 72, fig. 3b; Webster, 1998: 9, fig. c); ‘ashibetsuensis-Typ’: schmale verbreiterte Segmente mit sowohl basalen als auch terminalen Kapillarsegmenten (Bobrov et al., 2014: 133, fig. 5); ‘baudotii-Typ’: gerundete Segments mit parallelen Rändern, teilweise mit basalen Kapillarsegmenten, oft fleischig (Cook, 1966: 72, fig. 3a; Webster, 1998: 9, fig. b); ‘bungei-Typ’: mit bis zu 12 handförmig gespreizten spitzen Segmenten mit parallelen Rändern; ‘peltatus-Typ’: breit-flächig mit terminalen Kapillarsegmenten (Cook, 1966: 72, fig. 3c; Webster, 1998: 9, fig. d); ‘tripartitus-Typ’: radialsymmetrisch mit 3(-5) zugespitzten Lappen (Webster, 1998: 9, fig. a).
Tauchblätter (Kapillarblätter) − Anwesend oder fehlend. Blattstellung: wechselständig, (pseudo-)gegenständig. Länge (von Blattstiel und kapillar zerteiltem Teil), in cm; oder eingeteilt in Klassen als klein (< 30 mm lang), mittelgroß (30-60 mm lang), groß (> 60 mm lang). Form des Blattes (räumliche Dimension): 2-dimensional (in einer Ebene liegend): kreisförmig, halbkreisförmig; 3-dimensional: kugelig, halbkugelig, kegelförmig, kegelartig, oder verlängert kegelartig. Farbe: hellgrün, dunkelgrün, gelblich, bräunlich, schwärzlich (wenn frisch); Änderungen bei Trocknung. Behaarung: behaart, unbehaart. Zerteilter Teil des Blattes: Struktur der kapillaren Segmente: fleischig, mehr oder weniger starr, pinselnd. Pinselnde Segmente können faden förmig sein, zum Teil nur terminal. Orientierung der Segmente: spreizend, subparallel, parallel, zusammen fallend. Länge des mittleren Teils: kürzer als die seitlichen Teile. Abstand zwischen erster und zweiter Gabelung des zerteilten Teils. Anzahl der Gabelungen: 3, 4, 5, 6 oder mehr. Resultierende Anzahl der Endsegmente: zwischen 10 und 900. Länge des Blattstiels (inclusive Nebenblätter) in mm, oder in Klassen eingeteilt als kurz (< 10 mm), lang (> 10 mm).
Nebenblätter − Verwachsung mit dem Blattstiel: Anteil des verwachsenen Teils in Bezug auf Gesamtlänge des Nebenblattes in Prozent. Form des freien Teils: spitz, halbkreisförmig, abgerundet, keilförmig, in den Blattstiel verschmälert (Cook, 1966: 69; Webster, 1998: 54). Behaarung: behaart, unbehaart.
Stängel − Sprossdimorphismus bei mehrjährigen Arten: vegetativ, generativ. Gesamtlänge des Sprosses (vom Grund aus): in cm, oder eingeteilt in drei Klassen; klein (< 30(-50) cm lang), mittelgroß (50-150 cm lang), groß (> 200 cm lang). Verzweigungsmuster: dichotome Verzweigung, blattachselbürtige Verzweigung. Durchmesser in mm. Behaarung: behaart, unbehaart. Farbe: weißlich, hellgrün, dunkelgrün, gelblich, bräunlich, rötlich (durch spezielle Haare), schwärzlich (wenn frisch); Änderungen bei Trocknung. Länge der Internodien im Verhältnis zu benachbarten Strukturen (Blätter, Blattstiele oder Blütenstiele). Bewurzelung: Primärwurzel noch vorhanden; Adventivwurzel-Bildung: nur im unteren Teil des Sprosses, an jedem Knoten.
Blüte und Frucht
Blütenstiel − Länge zur Fruchtreife. Position in Relation zu verschiedenen Blatttypen. Länge in Relation zum gegenüberliegenden Blatt. Verlängerung zur Fruchtreife. Form zur Fruchtreife: gerade, zurückgebogen, aufgerollt. Behaarung: behaart, unbehaart. Durchmesser: in mm; gleichmäßig, zur Blüte verschmälert.
Kelchblätter − Anzahl. Größe: Länge, Breite in mm. Form: länglich-eiförmig, eiförmig, elliptisch, lanzettlich. Farbe: grün, grünlich, weißlich, gelb-grün, purpurn, blau, blauspitzig, mit dunkler Spitze. Räumliche Orientierung: ausgebreitet, zurückgeschlagen. Persistenz: hinfällig, ausdauernd.
Kronblätter − Anzahl. Größe: Länge, Breite in mm. Größe der Blüte: klein (Kronblätter < 5 mm lang), mittelgroß (Kronblätter 5-10 mm lang) oder groß (Kronblätter > 10 mm lang). Länge in Relation zu den Kelchblättern. Form: länglich-eiförmig, eiförmig, elliptisch, lanzettlich, spatelförmig. Farbe: weiß, weiß mit gelbem Nagel (der gelbe Nagel kann sehr klein oder normal groß sein). Form des Randes: ganzrandig, gewellt, gelappt oder gezähnt. Überlappung zur Blütezeit: überlappend, nicht-überlappend.
Nektarien − Anzahl per Kronblatt. Form: halbmond-förmig, tassenförmig vertieft, kreisförmig, verlängert, birnförmig, hufeisen-förmig, irregulär (vgl. Dahlgren, 1992; Cook, 1966: 76; Pizarro, 1995: 45; Webster, 1998: 55).
Staubblätter − Anzahl. Länge: länger als die Narbe, kürzer als die Narbe.
Fruchtblätter − Anzahl.
Frucht − Größe der reifen Frucht: Länge in mm, oder in Klassen eingeteilt als klein (< 1.2 mm lang), mittelgroß (1.2-2.0 mm lang) oder groß (> 2.0 mm lang); Breite. Form: länglich-eiförmig, eiförmig, elliptisch, halbkugelig, kugelig. Behaarung wenn reif (Behaarung kann auf den terminalen Teil beschränkt sein oder im Laufe der Entwicklung verloren gehen). Flügel: vorhanden oder fehlend (in getrocknetem Zustand); Position der Flügel: dorsal, ventral, beides. Position des Griffels: seitlich, subterminal , terminal. Länge des Griffels, in mm. Persistenz des Griffels: hinfällig, ausdauernd.
Sterilität − Schwierigkeiten in der Entwicklung zeigen Sterilität an: unterentwickelte Blütenstiele, unterentwickelte Kronblätter, regelmäßig fehlschlagende Früchte; vor allem, wenn am sechsten Blütenstiel noch keine reifen Früchte gebildet werden.
Blütenboden − Form zur Blütezeit: kugelig, halbkugelig, elliptisch, kegelförmig. Verlängerung zur Fruchtreife: nicht verlängert, verlängert. Form zur Furchtreife: wie zur Blütezeit, pfriemlich, Behaarung: stark behaart, behaart, vereinzelt behaart, unbehaart.
zu Nomenklatur und Verbreitungsangaben
Eine Schwierigkeit für die Benennung der Arten ist die unzureichende Typisierung. Nur 13 der 30 von Wiegleb et al. (2017) aufgeführten Arten sind durch einen authentischen Beleg verifiziert, der seit Erstbeschreibung als solcher betrachtet wurde. Dazu gehört von den deutschen Arten nur R. fluitans. In sieben Fällen wurde mangels eindeutigen Materials ein Lectotypus designiert (darunter R. aquatilis, R. hederaceus und R. pseudofluitans). Dies geschah bis zu 210 Jahre später, was eine lange Periode der Unsicherheit impliziert. Von drei Arten wurden historische Belege als Neotypen designiert (darunter R. peltatus und R. trichophyllus), von drei weiteren Arten historische Abbildungen (darunter R. circinatus und R. ololeucos). Die ursprüngliche Sammlung von R. saniculifolius ist verlorengegangen, ein Neotypus wurde nie designiert. Die als Typen betrachteten Belege von R. penicillatus und R. baudotii stellen möglicherweise nicht die Art dar, die heute unter diesen Namen verstanden wird (vgl. Anmerkungen bei R. fluitans-Hybriden; Jeanmonod & Naciri 2021: R. baudotii vs. R. saniculifolius). Weitere bedeutende Taxa wurden übersehen, so etwa R. peucedanifolius All., der bereits vor R. trichophyllus Chaix publiziert wurde.
Insofern waren Fehlbestimmungen lange Zeit vorprogrammiert. Falsche Einordnung in Herbarien führte zu falschen Angaben in Floren sowie falschen Einträgen in Datenbanken, aus denen automatische Verbreitungskarten generiert wurden (z.B. Euro+Med-Plantbase, GBIF, FloraWeb). In vielen deutschen Herbarien wurden oft nur die vor 1800 beschriebenen Arten R. aquatilis, R. circinatus, R. fluitans, R. hederaceus und R. trichophyllus unterschieden, manchmal wurde ein Faszikel für R. peltatus angelegt, nachdem 1976 erstmals die Cook’sche Nomenklatur im Kritischen Band des Rothmaler verwendet wurde. Während in der Fachliteratur damals häufig verwendete obsolete Synonyme (R. radians für R. aquatilis, R. paucistamineus für R. trichophyllus, R. divaricatus für R. circinatus) weitgehend ausgestorben sind, bestehen diese in manchen Herbarien und damit auch in Datenbanken weiter. In vegetationskundlichen Arbeiten wurden bis ca. 1980 oft nur R. aquatilis, R. circinatus und R. fluitans unterschieden. Dieser Tatbestand ist verwunderlich, da alle in Mitteleuropa vorkommenden Arten seit 1874 (zuletzt R. penicillatus) mit hinreichender Präzision beschrieben sind.
Nach den zwischen 2016 und 2018 durchgeführten Herbar-Revisionen ist R. peltatus die in Deutschland bei weitem häufigste Art. Ebenfalls häufig sind R. circinatus und R. trichophyllus. Dann folgen mit deutlichem Abstand R. aquatilis, R. fluitans, R. hederaceus und R. baudotii. Alle anderen Arten sind selten oder nur regional vertreten (vgl. Tab. 3).
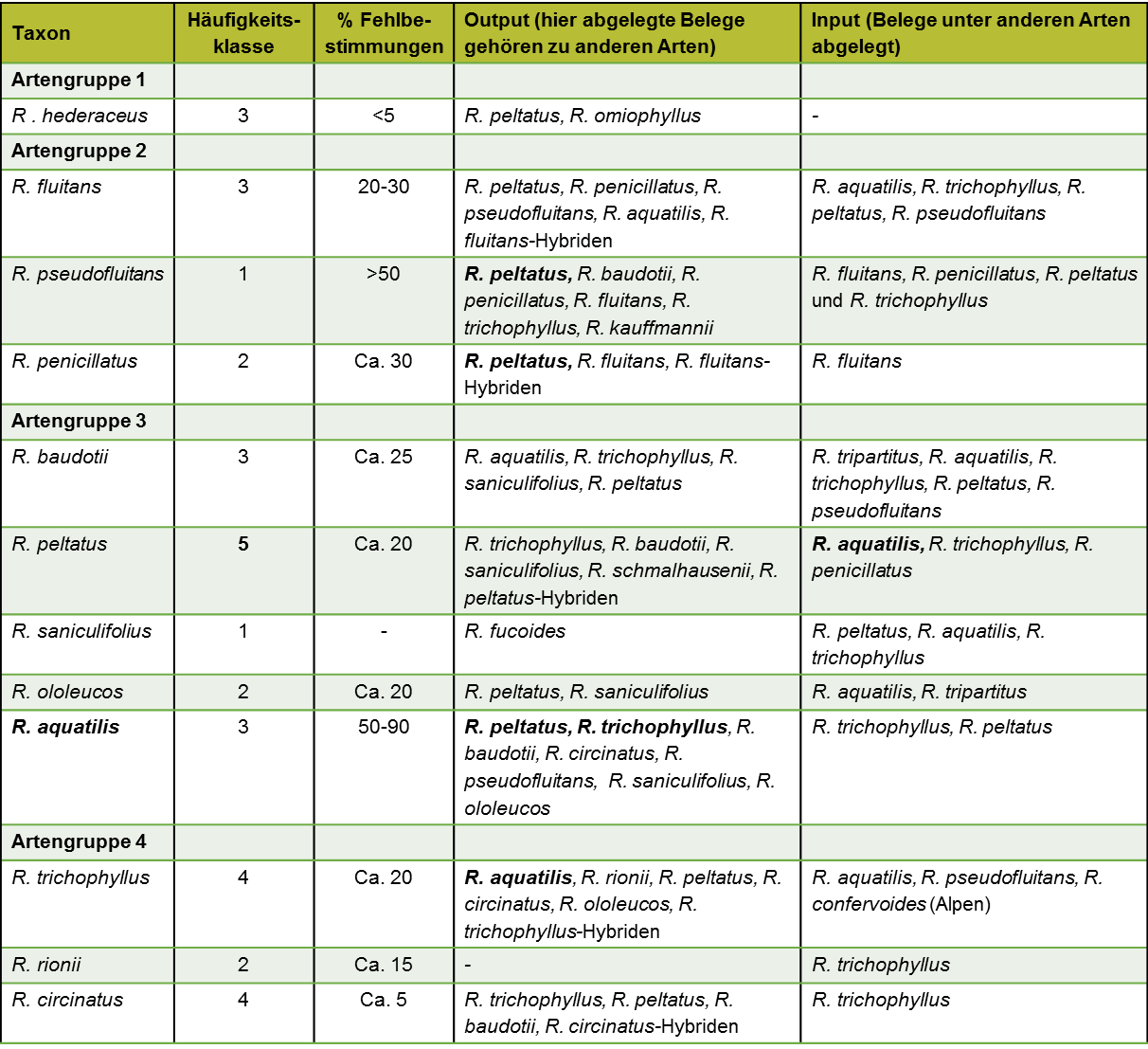
Als korrekte Bestimmungen wurden diejenigen gewertet, die sich eindeutig auf den Typus beziehen. Für R. peltatus sind zum Beispiel auch B. peltatum oder R. peltatus subsp. peltatus „korrekt“. Der Name ‚R. floribundus‘ ist zwar ein Synonym von R. peltatus, wurde aber außerhalb Großbritanniens nicht immer als solches verwendet. Namen wie ‚R. aquatilis var. truncatus‘ oder ‚R. aquatilis β peltatus‘ beziehen neben R. peltatus immer weitere Sippen mit ein. Die meisten Fehlbestimmungen betreffen R. aquatilis. Diese Art wurde lange Zeit als Sammelart (‚R. aquatilis s.l.‘, ‚R. aquatilis agg.‘) betrachtet und auch nach Erscheinen der Arbeit von Cook (1966) nicht korrekt behandelt. Mehr als 40-70% von R. aquatilis gehören in der Regel zu R. peltatus, nochmal 10-20% zu R. trichophyllus. Umgekehrt wurden viele Formen von R. trichophyllus für R. aquatilis gehalten, was sich in der Bilanz fast ausgleicht. Bei den Aufsammlungen nach 1970 wurden häufig R. penicillatus und R. pseudofluitans gefunden, die aber nur spezielle Morphotypen anderer Arten darstellen, insbesondere R. peltatus. Hybriden wurden in Sammlungen nur selten unterschieden. Eine Ausnahme bilden Belege der von Cook (1966) und Vollrath & Kohler (1972) beschriebenen Pflanzen. Für die Überarbeitung der Verbreitungskarten bei FloraWeb.de hat das einige Auswirkungen.
R. aquatilis s.l.: Die Karte hat keine Aussagekraft, da die Abgrenzung von anderen Arten unterschiedlich gehandhabt wurde.
R. aquatilis: Die Schwerpunkte in Schleswig-Holstein, Mecklenburg-Vorpommern, am Niederrhein und in Westfalen, dem Havel-Spreegebiet und Nordbayern sind realistisch. Insgesamt ist die Art aber auch dort seltener als bisher angenommen und zudem abnehmend.
R. circinatus: Die Schwerpunkte im Rhein-, Ems-, Weser- und Elbtal, auf der norddeutschen Jungmoräne, in Nordbayern sowie dem Voralpenland sind realistisch.
R. confervoides: Die auf der Karte dargestellten Vorkommen gehören zu R. trichophyllus.
R. fluitans: Die Karte ist teilweise lückenhaft, z.B. im Rheinischen Schiefergebirge, sonst aber realistisch. Die Vorkommen im Küstengebiet beziehen sich nicht auf diese Art sondern auf R. baudotii oder R. penicillatus.
R. hederaceus: Die Karte ist realistisch.
R. ololeucos: Die Karte ist realistisch.
R. baudotii (als subsp. von R. peltatus): Die Karte ist im Küstenbereich zutreffend, Binnenlandstandorte sind häufiger anzutreffen.
R. peltatus (als subsp.): Die Karte ist weitgehend korrekt. Durch die Verwechslung mit R. aquatilis kommt die besondere Häufigkeit in den Saale-eiszeitlichen Sandgebieten sowie den sauer-verwitternden Mittelgebirgen nicht genügend zur Geltung.
R. penicillatus: Die Karte enthält R. penicillatus, R. pseudofluitans sowie weitere R. fluitans-Hybriden. Das ist nicht differenziert genug. Die genaue Verbreitung der einzelnen Taxa lässt sich aber bisher aus Mangel an Material nicht darstellen.
R. rionii: Die Verbreitung ist unvollständig dargestellt, die jüngst entdeckten Vorkommen in West- und Mitteldeutschland von Nordrhein-Westfalen und Hessen bis Sachsen fehlen.
R. trichophyllus: Die Karte ist realistisch. Die häufige Verwechslung mit R. aquatilis wirkt sich nicht auf das Verbreitungsmuster aus, da beide Arten ähnliche ökologische Ansprüche haben.
Ich danke K. Wesche (Görlitz) und K. van de Weyer (Nettetal) für die mehrfache Durchsicht des Manuskriptes; P. Gebauer (Görlitz, GLM) und C. Barilaro (Oldenburg, LMO) für die Unterstützung bei der Herbararbeit; alle weiteren Kuratoren der Herbarien, die Material zur Verfügung stellten oder durch Zusendung von Scans Typisierungsfragen zu klären halfen; J. Zalewska-Galocz (KRA) für die Diskussionen zu taxonomischen und nomenklatorischen Fragen.
Bobrov, A. A., Erst, A. S., Ankova, T. V., Movergoz, E. A. 2015a. Chisla khromosom vodyanykh lyutikov (Ranunculus sektsiya Batrachium, Ranunculaceae) flory Rossii [Chromosome numbers of water crowfoots (Ranunculus section Batrachium, Ranunculaceae) of the flora of Russia]. Bot. Zhurn. [Bot. J., St. Petersburg]. 100(6): 595-600. (in Russian)
Buttler, K. P., Thieme, M. et al. 2017. Florenliste von Deutschland – Gefäßpflanzen, Version 9. (Aktuelle Version)
Casper, S. J., Krausch, H. D. 1981. Pteridophyta und Anthophyta, 2. Teil: Saururaceae bis Asteraceae. In: Ettl, H., Gerloff, J., Heynig. (Hrsg.). Süßwasserflora von Mitteleuropa, Bd. 24, Gustav Fischer, New York, pp. 409-942.
Cook, C. D. K. 1966. A monographic study of Ranunculus subgenus Batrachium (DC.) A. Gray. Mitt. Bot. Staatssamml. München. 6: 47-237.
Cook, C. D. K. 1986. Subgenus I. Batrachium (DC.) A. Gray. In: Castroviejo, S. et al. (Hrsg.). Flora Iberica, Vol. 1, Lycopodiaceae-Papaveraceae, p. 285-298. Madrid.
Dahlgren, G. 1992. Ranunculus subgenus Batrachium on the Aegean islands and adjacent areas: nectary types and breeding system. Nordic J. Bot. 1992. 12(3): 299-310. https://dx.doi.org/10.1111/j.1756-1051.1992.tb01305.x
Dahlgren, G., Jonsell, B. 2001. 13. Ranunculus hederaceus L.– 19. Ranunculus penicillatus (Dumort.) Bab..In: Jonsell, B. (Hrsg.) Flora Nordica. Vol. 2 Chenopodiaceae to Fumariaceae. The Bergius Foundation, Stockholm, pp. 229, 259–269.
Desfayes, M. 2016. Status des rénoncules aquatiques du genre Ranunculus L. subgen. Batrachium en Suisse. Bulletin de la Societé Vaudoise des Sciences Naturelles 95: 21–32.
Englmaier, P. 2016: Ranunculus sect. Batrachium (Ranunculaceae): Contribution to an excursion flora of Austria and the Eastern Alps. Neilreichia 8: 97–125.
Glück, H. 1936. Pteridophyten und Phanerogamen, in Pascher, A. (Ed.), Die Süßwasserflora Europas, Heft 15, Gustav Fischer, Jena. 486 pp.
Hand, R., Thieme M. & Mitarbeiter 2020 ff. Florenliste von Deutschland (Gefäßpflanzen), begründet von Karl Peter Buttler, Version 11 ff. [online]. (Aktuelle Version)
Hong, D. Y. 1991. A biosystematic study in Ranunculus subgenus Batrachium in S Sweden. Nordic Journal of Botany 11: 41–59. https://dx.doi.org/10.1111/j.1756-1051.1991.tb01793.x
Hörandl, E. & von Raab-Straubl, E. 2015. Ranunculeae. In: Euro+Med Plantbase – the information resource for Euro-Mediterranean plant diversity.
Hörandl, E., Paun, O., Johansson, J. T., Lehnebach, C., Armstrong, T., Chen, L. & Lockhart, P. 2005. Phylogenetic relationships and evolutionary traits in Ranunculus s.l. (Ranunculaceae) inferred from ITS sequence analysis. Molecular Phylogenetics and Evolution 36: 305–327. https://dx.doi.org/10.1016/j.ympev.2005.02.009
Jeanmonod, D. & Naciri, Y. 2021. Révision taxonomique de Ranunculus sect. Batrachium en Corse: une analyse morphologique et statistique. Candollea 75: 275-292. https://doi.org/10.15553/c2021v762a9
Koutečky, P., Prančl, J., Košnar, K., Koutecká, E., Hanzlíčková, J., Lučcanová, M., Nejdlá, M., Kaplan, Z. 2022. Waking up from a taxonomist’s nightmare: emerging structure of Ranunculus section Batrachium (Ranunculaceae) in central Europe mased on molecular and genome data. Botanical Journal of the Linnean Society 198: 417-437. https://doi.org/10.1093/botlinnean/boab063
Lansdown, R. V. 2007. The identity of Ranunculus subgenus Batrachium in the River Itchen. Ardeola Environmental Services, Stroud.
Lansdown, R. V. 2015. Ranunculus subgenus Batrachium (DC.) A. Gray. In: Stace, C. A., Preston, C. D. & Pearman, D. A. (Hrsg.): Hybrid flora of the British Isles. BSBI, Bristol, pp. 36–42.
Luferov, A. N. 2002. Novye taksony i nomenclaturnye kombintsii roda Ranunculus L. (Ranunculaceae Juss.) [New taxa and nomenclatural combinations of the genus Ranunculus L. (Ranunculaceae Juss.)]. Byull. Mosk. Obsch. Ispyt. Prir. Otdel Biol. [Bull. Moscow Soc. Naturalists. Bio. Series]. 107(2): 31–35. (in Russian)
Meyer, T. 2018. Flora-de: Flora von Deutschland. Weiße, im Wasser lebende Hahnenfüße (früherer Gattungsname: Batrachium). https://www.blumeninschwaben.de/Zweikeimblaettrige/Hahnenfuss/wasserrranunculus.htm
Paule, J., Gregor, T., Schmidt, M., Gerstner, E. M., Dersch, G., Dressler, S., Wesche, K. & Zizka, G. 2017. Chromosome numbers of the flora of Germany – a new online database of georeferenced chromosome counts and flow cytometric ploidy estimates. Plant Systematics and Evolution 303: 1123–1129.
Pizarro, J. 1995. Contributión al estudio taxonómico de Ranunculus L. subgen. Batrachium (DC.) A. Gray (Ranunculaceae). Lazaroa. 15: 21-113. (Volltext)
Prančl, J., Koutecký, P., Travniček, P., Jarolimová, V., Lučanocá, M., Koutecká, E. & Kaplan, Z. 2018. Cytotype variation, cryptic diversity and hybridization in Ranunculus sect. Batrachium revealed by flow cytometry and chromosome numbers. Preslia 90: 195-223. (Volltext)
Rice, A., Glick, L., Abadi, S., Einhorn, M., Kopelman, N. M., Salman-Minkov, A., Mayzel, J., Chay, O. & Mayrose, I. 2015. The Chromosome Counts Database (CCDB) – a community resource of plant chromosome numbers. New Phytologist 206: 19–26.
Stünzi, J., Cook, C. D. K. & Thomas, E. A. 1979. Karyologische Untersuchungen verschiedener Populationen von Ranunculus fluitans Lam. Im Nordosten der Schweiz. Vierteljahrsschrift der naturforschenden Gesellschaft in Zürich 124: 133–139.
Turała-Szybowska, K. 1977. Karyological studies in Ranunculus fluitans Lam. from Thuringia and Vilnius and its surroundings. Acta Biologica Cracoviensis, Ser. Bot. 20: 1–9.
Tzvelev, N.N., 1998. Rod Batrachium (DC.) S. F. Gray (Ranunculaceae) v Vostochnoi Evrope [Genus Batrachium (DC.) S. F. Gray (Ranunculaceae) in East Europe]. Nov. Syst. Plant. Vascul. 31: 67–81. (in Russian)
Vollrath, H. & Kohler, A. 1972. Batrachium-Fundorte aus bayerischen Naturräumen. Berichte der Bayerischen Botanischen Gesellschaft 43: 63–75.
Wang, W.T., Tamura, M. 2001. 35. Batrachium (de Candolle) Gray, in: Flora of China. Vol. 6. Science Press, Beijing; Miss. Bot. Gard. Press, St. Louis, pp. 431-438.
Webster, S. D. 1988. Ranunculus penicillatus (Dumort.) Bab. in Great Britain and Ireland. Watsonia 17: 1–22.
Webster, S. D. 1998. Ranunculus subgenus Batrachium. In: Rich, T.C.G. & Jermy, A.C. (Eds.): Plant Crib. BSBI, London, pp. 51–64. (updated by T.C.G. Rich, 2012).
Weyer, K. van de. 2017: NRW-Verfahren zur Bewertung von Fließgewässern mit Makrophyten. Fortschreibung und Metrifizierung. 2. überarb. u. erg. Aufl. LANUV Arbeitsblatt 30. Recklinghausen.
Weyer, K. van de & Schmidt, C. 2011. Bestimmungsschlüssel für die aquatischen Makrophyten (Gefäßpflanzen, Armleuchteralgen, Moose) in Deutschland. Bd. 1: Bestimmungsschlüssel. Fachbeiträge des LUGV Brandenburg 119: 1–158. (Version von 2007)
Whittemore, A. T. 1997. 2e. Ranunculus Subg. Batrachium (de Candolle) Seringe, in: Flora of North America north of Mexico. Vol. 3. Oxford University Press, New York-Oxford, pp. 130.
Wiegleb, G. & Herr, W. 1983.Taxonomie und Verbreitung von Ranunculus subgenus Batrachium in niedersächsischen Fließgewässern unter besonderer Berücksichtigung des Ranunculus penicillatus Komplexes. Göttinger Floristische Rundbriefe 17: 101–150.
Wiegleb, G., Zalewska-Gałosz, J. & Bobrov. A. A. 2017. A taxonomic account of Ranunculus section Batrachium (Ranunculaceae). Phytotaxa 319: 1-55. (Volltext)
Wiegleb, G. 2018: Die Neubearbeitung der Familie Potamogetonaceae und der Sektion Batrachium (Ranunculus, Ranunculaceae) für die 22. Auflage des Rothmaler, Exkursionsflora von Deutschland. Schlechtendalia 35: 45-61. (Volltext)
Wiegleb, G. 2020. Ranunculus Sektion Batrachium. In: Jäger, E. J. & Kadereit, W. (Hrsg.). Die Ranunculaceae der Flora von Zentraleuropa. Online publiziert von der GEFD. (Volltext)
Wiegleb, G. 2021. Ranunculus Sektion Batrachium. In: Müller, F., Ritz, C., Welk, E. & Wesche, K. (Hrsg.). Rothmaler, Exkursionsflora von Deutschland. Gefäßpflanzen: Grundband. 22. Auflage. Springer Spektrum: xxx-xxx.
Wolff, P. & Schwarzer, A. 1991. Ranunculus rionii Lagger – eine neue Wasserpflanze in Deutschland. Floristische Rundbriefe 25: 69–85.
Zalewska-Gałosz, J., Jopek, M., Ilnicki, T. 2015. Hybridization in Batrachium group: Controversial delimitation between heterophyllous Ranunculus penicillatus and the hybrid Ranunculus fluitans × R. peltatus. Aquat. Bot. 120: 160-168. https://dx.doi.org/10.1016/j.aquabot.2014.03.002
Zander, B., Wiegleb, G. 1987. Biosystematische Untersuchungen an Populationen von Ranunculus subgenus Batrachium in Nordwestdeutschland. Botanische Jahrbücher Systematik 109(1): 81-130.
Wiegleb, G. 2021 (aktualisiert 2022, veröffentlicht 2025). Ranunculus L. sect. Batrachium DC. In: Dressler, S., Gregor, T., Hellwig, F., Korsch, H., Wesche, K., Wesenberg, J. & Ritz, C. M. Bestimmungskritische Taxa zur Flora von Deutschland. Herbarium Senckenbergianum Frankfurt/Main, Görlitz & Herbarium Haussknecht Jena. [online] https://bestikri.senckenberg.de/




